摘要:11. 答案:(1)BaCl2+Na2SO4BaSO4↓+2NaCl (2)Na2CO3+H2SO4Na2SO4↓+CO2↑+2H2O (3)Fe2O3+6HCl2FeCl3+3H2O (4)Cl2+2NaOHNaCl+NaClO+H2O (说明:以上各小题答案不唯一.其他合理答案也对)
网址:http://m.1010jiajiao.com/timu3_id_191678[举报]
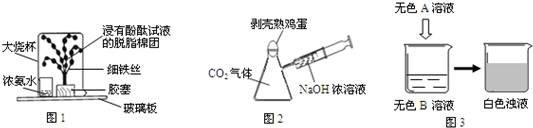
春节联欢晚会上,刘谦的魔术表演激起了人们强烈的好奇心,并在全国范围内掀起了魔术表演的热潮.在校园文化节活动中,一位高一年级同学给初中同学表演了一组化学小魔术,请你利用所学化学知识揭开其中之谜.
(1)魔术一:“奇花变色”
道具如图1所示,该魔术中可观察到“铁树”上浸有无色酚酞试液的棉团由白色变为
A.氨分子是不断运动的 B.氨分子有一定质量
C.浓氨水具有挥发性 D.氨气的水溶液显碱性
(2)魔术二:“瓶吞鸡蛋”
道具如图2所示,将注射器中NaOH浓溶液注入瓶中,片刻后会看到鸡蛋被“吞”入瓶中.该魔术中涉及的化学反应为
(3)魔术三:“‘清水’变‘牛奶’”
道具如图3所示,当A溶液加到烧杯中,无色溶液变成白色浊液.若A为酸溶液,则A、B的可能组合:A为
查看习题详情和答案>>
(1)魔术一:“奇花变色”
道具如图1所示,该魔术中可观察到“铁树”上浸有无色酚酞试液的棉团由白色变为
红
红
色.该魔术中没有涉及的性质是B
B
(填字母序号).A.氨分子是不断运动的 B.氨分子有一定质量
C.浓氨水具有挥发性 D.氨气的水溶液显碱性
(2)魔术二:“瓶吞鸡蛋”
道具如图2所示,将注射器中NaOH浓溶液注入瓶中,片刻后会看到鸡蛋被“吞”入瓶中.该魔术中涉及的化学反应为
2NaOH+CO2=Na2CO3+H2O或NaOH+CO2=NaHCO3
2NaOH+CO2=Na2CO3+H2O或NaOH+CO2=NaHCO3
(用化学方程式表示).(3)魔术三:“‘清水’变‘牛奶’”
道具如图3所示,当A溶液加到烧杯中,无色溶液变成白色浊液.若A为酸溶液,则A、B的可能组合:A为
H2SO4
H2SO4
;B为BaCl2(HCl和AgNO3.或其他合理答案)
BaCl2(HCl和AgNO3.或其他合理答案)
.(只需写一组)
某研究性学习小组对NaHCO3溶液进行如下探究.
Ⅰ探究NaHCO3溶液在不同温度下pH变化的原因
(1)小组同学测得饱和NaHCO3溶液在不同温度下的pH如下:
分析上述溶液pH增大的原因:
①甲同学认为是温度升高促进了HCO3-的水解,溶液pH增大.写出HCO3-水解的离子方程式: .
②乙同学认为溶液pH增大的原因还与NaHCO3在水溶液中受热分解产生Na2CO3有关.Na2CO3水解程度 (填“大于”或“小于”)NaHCO3.
③丙同学为验证甲、乙两同学的观点,进行了如下实验:
实验1:将加热后的溶液冷却至 10℃,测得此时溶液pH大于8.3;
实验2:在加热煮沸后已冷却的溶液中加入足量的试剂X,产生沉淀.
分析上述验证实验,可说明乙同学观点是 (填“合理”或“不合理”)的.
实验2中试剂X是 .
A.Ba(OH)2溶液 B.BaCl2溶液 C.NaOH溶液 D.澄清石灰水
Ⅱ配制1.00mol?L-1NaHCO3溶液,测定其分解率
(2)配制1.00mol?L-1NaHCO3溶液100mL.容量瓶上可以看到的标记是 .
A.温度 B.容量 C.刻度线 D.溶液物质的量浓度
(3)小组同学取室温下已敞口放置一段时间的上述NaHCO3溶液50.00mL,与足量的稀盐酸反应,测定产生CO2的量,设计了如下装置.
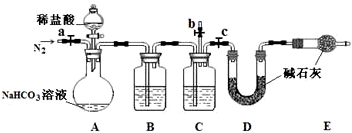
①上述装置C中盛装的试剂为 .
②往A中加入稀盐酸前,为赶出装置中的空气,先通入N2一段时间.此过程应进行的操作是 .
③若实验测得D装置增重 2.14g,则溶液中NaHCO3的分解率是 .
查看习题详情和答案>>
Ⅰ探究NaHCO3溶液在不同温度下pH变化的原因
(1)小组同学测得饱和NaHCO3溶液在不同温度下的pH如下:
| 温度/℃ | 10 | 20 | 30 | 加热煮沸后冷却至 50℃ | pH | 8.3 | 8.4 | 8.5 | 8.8 |
①甲同学认为是温度升高促进了HCO3-的水解,溶液pH增大.写出HCO3-水解的离子方程式:
②乙同学认为溶液pH增大的原因还与NaHCO3在水溶液中受热分解产生Na2CO3有关.Na2CO3水解程度
③丙同学为验证甲、乙两同学的观点,进行了如下实验:
实验1:将加热后的溶液冷却至 10℃,测得此时溶液pH大于8.3;
实验2:在加热煮沸后已冷却的溶液中加入足量的试剂X,产生沉淀.
分析上述验证实验,可说明乙同学观点是
实验2中试剂X是
A.Ba(OH)2溶液 B.BaCl2溶液 C.NaOH溶液 D.澄清石灰水
Ⅱ配制1.00mol?L-1NaHCO3溶液,测定其分解率
(2)配制1.00mol?L-1NaHCO3溶液100mL.容量瓶上可以看到的标记是
A.温度 B.容量 C.刻度线 D.溶液物质的量浓度
(3)小组同学取室温下已敞口放置一段时间的上述NaHCO3溶液50.00mL,与足量的稀盐酸反应,测定产生CO2的量,设计了如下装置.

①上述装置C中盛装的试剂为
②往A中加入稀盐酸前,为赶出装置中的空气,先通入N2一段时间.此过程应进行的操作是
③若实验测得D装置增重 2.14g,则溶液中NaHCO3的分解率是
只用一种试剂即可除去下列各物质中的杂质(括号内为杂质),试写出所用试剂及有关反应的离子方程式.
(1)BaCl2(HCl) 选用试剂
(2)CO2(HCl) 选用试剂
(3)NaCl(Na2SO4) 选用试剂
(4)FeCl2(FeCl3) 选用试剂
查看习题详情和答案>>
(1)BaCl2(HCl) 选用试剂
BaCO3粉末
BaCO3粉末
,离子方程式BaCO3+2H+═Ba2++CO2↑+H2O
BaCO3+2H+═Ba2++CO2↑+H2O
.(2)CO2(HCl) 选用试剂
饱和NaHCO3溶液
饱和NaHCO3溶液
,离子方程式HCO3-+H+═CO2↑+H2O
HCO3-+H+═CO2↑+H2O
.(3)NaCl(Na2SO4) 选用试剂
BaCl2溶液
BaCl2溶液
,离子方程式Ba2++SO42-═BaSO4↓
Ba2++SO42-═BaSO4↓
.(4)FeCl2(FeCl3) 选用试剂
铁粉
铁粉
,离子方程式2Fe3++Fe═3Fe2+
2Fe3++Fe═3Fe2+
.粗盐的提纯,常常加入一些化学试剂,使一些可溶性的杂质沉淀下来,过滤而除去,同时采用必要的操作,下列操作顺序正确的是( )
①加BaCl2 ②加NaOH ③加Na2CO3 ④加稀盐酸 ⑤过滤.
①加BaCl2 ②加NaOH ③加Na2CO3 ④加稀盐酸 ⑤过滤.
| A、①②③④⑤ | B、⑤④③②① | C、①②③⑤④ | D、③①②⑤④ |