摘要:(C6H10OO5)n+nH2OnC6H12O6,C6H12O62C2H5OH+2CO2↑, 第二课时 有机高分子的合成 巩固练习
网址:http://m.1010jiajiao.com/timu3_id_191478[举报]
A、B、C均为常见的物质,且有如下转化关系:
(1)若M是第IVA族某元素的最高价氧化物,且M为气体,组成A的阴阳离子均含有10个电子.
①请用离子方程式表示C溶液呈现酸碱性的原因:
②用石墨电极电解B的饱和溶液时,观察到的现象是
阳极反应式为
(2)若A、B、C均为含硫元素的物质,则A分子中的化学键类型是
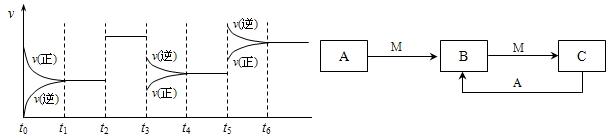
①若C在一定条件下可发生如下的反应:2SO2+O2 2SO3△H<0,下图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量.下列说法中正确的是
2SO3△H<0,下图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量.下列说法中正确的是
A t2时加入了催化剂 B t3时降低了温度
C t5时增大了压强 D t4~t5时间内反应物的转化率最低
②一定温度下的密闭容器内,充入4mol SO2、2mol O2 发生反应2SO2+O2 2SO3达到平衡后,SO3的体积分数为 a%,SO2的转化率为m.
2SO3达到平衡后,SO3的体积分数为 a%,SO2的转化率为m.
等温等容时再充入2mol SO2、1mol O2,达到平衡时若SO3的体积分数为b%,SO2的转化率为n,则a
查看习题详情和答案>>

(1)若M是第IVA族某元素的最高价氧化物,且M为气体,组成A的阴阳离子均含有10个电子.
①请用离子方程式表示C溶液呈现酸碱性的原因:
HCO3-+H2O H2CO3+OH-
H2CO3+OH-
 H2CO3+OH-
H2CO3+OH-HCO3-+H2O H2CO3+OH-
H2CO3+OH-
. H2CO3+OH-
H2CO3+OH-②用石墨电极电解B的饱和溶液时,观察到的现象是
阴阳两极均有气体放出,溶液变浑浊或有晶体析出
阴阳两极均有气体放出,溶液变浑浊或有晶体析出
,阳极反应式为
4OH--4e-=O2↑+2H2O
4OH--4e-=O2↑+2H2O
,电解一段时间后,溶液的pH不变
不变
(填“增大”、“减小”或“不变”).(2)若A、B、C均为含硫元素的物质,则A分子中的化学键类型是
极性共价键
极性共价键
.①若C在一定条件下可发生如下的反应:2SO2+O2
 2SO3△H<0,下图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量.下列说法中正确的是
2SO3△H<0,下图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量.下列说法中正确的是A
A
.A t2时加入了催化剂 B t3时降低了温度
C t5时增大了压强 D t4~t5时间内反应物的转化率最低
②一定温度下的密闭容器内,充入4mol SO2、2mol O2 发生反应2SO2+O2
 2SO3达到平衡后,SO3的体积分数为 a%,SO2的转化率为m.
2SO3达到平衡后,SO3的体积分数为 a%,SO2的转化率为m. 等温等容时再充入2mol SO2、1mol O2,达到平衡时若SO3的体积分数为b%,SO2的转化率为n,则a
<
<
b,m<
<
n(填“>”、“=”或“<”,下同).若改为等温等压,则a═
═
b,m═
═
n.(2012?泰州二模)谷氨酸一钠盐是味精的主要成分,谷氨酸一钠盐在水溶液中存在如下平衡:
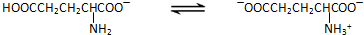
(1)当前我国生产味精主要采用淀粉发酵法,其中第一步是使淀粉水解为单糖.实验室中检验淀粉水解产物可选用的试剂是
A.NaOH溶液、氨水、AgNO3溶液 B.H2SO4溶液、氨水、AgNO3溶液
C.NaOH溶液、CuSO4溶液 D.H2SO4溶液、CuSO4溶液
(2)“沙伦逊甲醛滴定法”可用于测定味精中谷氨酸一钠盐的含量.其方法如下:
将一定质量的味精样品溶于水,再向溶液中加入36%甲醛溶液,发生的反应如下:
R-NH2+HCHO→R-N=CH2+H2O(R表示除“-NH2”外的基团),再以酚酞为指示剂,用NaOH溶液进行滴定.
①上述测定过程中加入甲醛的目的是
②滴定终点的实验现象为
(3)味精中常含食盐,有两个同学分别设计甲、乙两种方案来测定味精中NaCl的含量.
①甲方案:取一定质量味精样品溶于水,加入足量稀硝酸酸化的硝酸银溶液,充分反应后,
②乙方案:取mg味精溶于水,加入过量浓度为c1mol?L-1的AgNO3溶液,再加入少量
%
%.
查看习题详情和答案>>
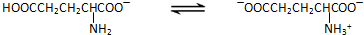
(1)当前我国生产味精主要采用淀粉发酵法,其中第一步是使淀粉水解为单糖.实验室中检验淀粉水解产物可选用的试剂是
AC
AC
.A.NaOH溶液、氨水、AgNO3溶液 B.H2SO4溶液、氨水、AgNO3溶液
C.NaOH溶液、CuSO4溶液 D.H2SO4溶液、CuSO4溶液
(2)“沙伦逊甲醛滴定法”可用于测定味精中谷氨酸一钠盐的含量.其方法如下:
将一定质量的味精样品溶于水,再向溶液中加入36%甲醛溶液,发生的反应如下:
R-NH2+HCHO→R-N=CH2+H2O(R表示除“-NH2”外的基团),再以酚酞为指示剂,用NaOH溶液进行滴定.
①上述测定过程中加入甲醛的目的是
掩蔽氨基,避免氨基影响羧基和NaOH的中和反应
掩蔽氨基,避免氨基影响羧基和NaOH的中和反应
.②滴定终点的实验现象为
溶液由无色变为红色且半分钟不褪色
溶液由无色变为红色且半分钟不褪色
.(3)味精中常含食盐,有两个同学分别设计甲、乙两种方案来测定味精中NaCl的含量.
①甲方案:取一定质量味精样品溶于水,加入足量稀硝酸酸化的硝酸银溶液,充分反应后,
过滤、洗涤、干燥
过滤、洗涤、干燥
(填写操作步骤),称量沉淀质量.②乙方案:取mg味精溶于水,加入过量浓度为c1mol?L-1的AgNO3溶液,再加入少量
Fe(NO3)3
Fe(NO3)3
溶液做指示剂,用浓度为c2mol?L-1的NH4SCN溶液进行滴定,当溶液变为红色时,达到滴定终点.已知:AgSCN是难溶于水的沉淀.设测定过程中所消耗的AgNO3溶液和NH4SCN溶液的体积分别为V1mL和V2mL,则该味精样品中NaCl的质量分数是| 5.85(c1V1-c2V2) |
| m |
| 5.85(c1V1-c2V2) |
| m |
下列实验不能达到预期目的是:( )
|
查看习题详情和答案>>
Ⅰ.A、B、C分别代表三种不同的短周期元素.A原子的最外层电子排布为ns1,B原子的价电子排布为ns2np2,C原子的最外层电子数是其电子层数的3倍.
(1)若A原子的最外层电子排布为1s1,则按原子轨道的重迭方式判断,A与C形成的化合物中的共价键类型属于
(2)当n=2时,B与C形成的晶体属于
Ⅱ.元素周期表中第四周期元素由于受3d电子的影响,性质的递变规律与短周期元素略有不同.第四周期过渡元素的明显特征是形成多种多样的配合物.
(3)CO可以和很多过渡金属形成配合物,如羰基铁[Fe(CO)5]、羰基镍[Ni(CO)4].CO分子中C原子上有一对孤对电子,C、O原子都符合8电子稳定结构,CO的结构式为
(4)第四周期元素的第一电离能随原子序数的增大,总趋势是逐渐增大的.镓的基态原子的电子排布式是
(5)用价层电子对互斥理论预测H2Se和BBr3的立体结构,两个结论都正确的是
a.直线形;三角锥形 b.V形;三角锥形
c.直线形;平面三角形 d.V形;平面三角形.
查看习题详情和答案>>
(1)若A原子的最外层电子排布为1s1,则按原子轨道的重迭方式判断,A与C形成的化合物中的共价键类型属于
σ
σ
键,A与C所形成的化合物的熔沸点明显高于A与C的同主族元素所形成的化合物的熔沸点,其原因是水分子之间存在氢键
水分子之间存在氢键
;(2)当n=2时,B与C形成的晶体属于
分子
分子
晶体.当n=3时,B与C形成的晶体中,B原子的杂化方式为sp3
sp3
,微粒间的作用力是共价键
共价键
;Ⅱ.元素周期表中第四周期元素由于受3d电子的影响,性质的递变规律与短周期元素略有不同.第四周期过渡元素的明显特征是形成多种多样的配合物.
(3)CO可以和很多过渡金属形成配合物,如羰基铁[Fe(CO)5]、羰基镍[Ni(CO)4].CO分子中C原子上有一对孤对电子,C、O原子都符合8电子稳定结构,CO的结构式为
C≡O
C≡O
,与CO互为等电子体的离子为CN-
CN-
(填化学式).(4)第四周期元素的第一电离能随原子序数的增大,总趋势是逐渐增大的.镓的基态原子的电子排布式是
1s22s22p63s23p63d104s24p1
1s22s22p63s23p63d104s24p1
,Ga的第一电离能却明显低于Zn,原因是Ga失去1个电子后内层电子达到全充满的稳定状态,而Zn的4s容纳2个电子、处于全满稳定状态,能量较低,Zn第一电离能较高
Ga失去1个电子后内层电子达到全充满的稳定状态,而Zn的4s容纳2个电子、处于全满稳定状态,能量较低,Zn第一电离能较高
.(5)用价层电子对互斥理论预测H2Se和BBr3的立体结构,两个结论都正确的是
d
d
.a.直线形;三角锥形 b.V形;三角锥形
c.直线形;平面三角形 d.V形;平面三角形.