摘要:B 2.B 3.A 4.A 5.B 6.B 7.B 8.A 9.D 10.C
网址:http://m.1010jiajiao.com/timu3_id_190948[举报]
ⅥA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种氧化态,含ⅥA族元素的化合物在研究和生产中有许多重要用途.请回答下列问题:
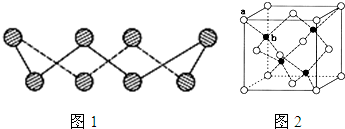
(1)S单质的常见形式是S8,其环状结构如图1所示,S原子采用的轨道杂化方式是
(2)原子的第一电离能是指气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量,O、S、Se原子的第一电离能由大到小的顺序为
(3)Se的原子序数为
(4)H2Se的酸性比 H2S
离子的立体构型为
(5)H2SeO3 的K1和K2分别是2.7×10-3和2.5×10-8,H2SeO4的第一步几乎完全电离,K2是1.2×10-2,请根据结构与性质的关系解释:
①H2SeO3和H2SeO4的第一步电离程度大于第二步电离的原因:
②H2SeO4比H2SeO3酸性强的原因:
(6)ZnS在荧光体、光导体材料、涂料、颜料等行业中应用广泛.立方ZnS晶体结构如图2所示,其晶胞边长为540.0pm,密度为
=4.1
=4.1g?cm-3(列式并计算),a位置S2-离子与b位置Zn2+离子之间的距离为
或
或135
或
或135
pm(列式表示)
查看习题详情和答案>>

(1)S单质的常见形式是S8,其环状结构如图1所示,S原子采用的轨道杂化方式是
sp3
sp3
;(2)原子的第一电离能是指气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量,O、S、Se原子的第一电离能由大到小的顺序为
O>S>Se
O>S>Se
;(3)Se的原子序数为
34
34
,其核外M层电子的排布式为3s23p63d10
3s23p63d10
;(4)H2Se的酸性比 H2S
强
强
(填“强”或“弱”).气态SeO3分子的立体构型为平面三角形
平面三角形
,| SO | 2- 3 |
三角锥形
三角锥形
;(5)H2SeO3 的K1和K2分别是2.7×10-3和2.5×10-8,H2SeO4的第一步几乎完全电离,K2是1.2×10-2,请根据结构与性质的关系解释:
①H2SeO3和H2SeO4的第一步电离程度大于第二步电离的原因:
第一步电离后生成的负离子较难再进一步电离出带正电荷的氢离子
第一步电离后生成的负离子较难再进一步电离出带正电荷的氢离子
;②H2SeO4比H2SeO3酸性强的原因:
H2SeO3和H2SeO4可表示为(HO)SeO和(HO)SeO2.H2SeO3中Se为+4价,而H2SeO4中Se为+6价,正电性更高.导致Se-O-H中的O原子更向Se偏移,越易电离出H+
H2SeO3和H2SeO4可表示为(HO)SeO和(HO)SeO2.H2SeO3中Se为+4价,而H2SeO4中Se为+6价,正电性更高.导致Se-O-H中的O原子更向Se偏移,越易电离出H+
.(6)ZnS在荧光体、光导体材料、涂料、颜料等行业中应用广泛.立方ZnS晶体结构如图2所示,其晶胞边长为540.0pm,密度为
| ||
| (540.0×10-10cm)3 |
| ||
| (540.0×10-10cm)3 |
| 270.0 | ||
|
135.0×
| ||
sin
|
| 3 |
| 270.0 | ||
|
135.0×
| ||
sin
|
| 3 |
A、B、C、D是短周期元素形成的四种气体单质.E、F均为气体,且F为红棕色.有关的转化关系如 下图所示(反应条件均已略去).
下图所示(反应条件均已略去).
请回答下列问题:
(1)D的化学式为
(2)反应③的离子方程式为
(3)Y和E在一定条件下可反应生成B和Z,这是一个具有实际意义的反应,可消除E对环境的污染,该反应的化学方程式为
(4)0.1mol/L的X溶液和0.1mol/L的Y溶液等体积混合,溶液呈
(5)常温下0.1mol/L的Y溶液中c(H+)/c(OH-)=1×10-8,下列叙述正确的是
A.该溶液的pH=11
B.该溶液中的溶质电离出的阳离子浓度0.1mol/L
C.该溶液中水电离出的c(H+)与c(OH-)乘积为1×10-22
D. pH=3的盐酸溶液V1 L与该0.1mol/L的Y溶液V2 L混合,若混合溶液pH=7,则:V1>V2
E.将pH=11的Y溶液加水稀释100倍后,pH值为9;
(6)化合物E在一定条件下于一定体积的容器中可发生身氧化还原反应,测得容器内气体的压强略小于原来的2/3,请写出该反应的化学方程式
查看习题详情和答案>>
 下图所示(反应条件均已略去).
下图所示(反应条件均已略去).请回答下列问题:
(1)D的化学式为
H2
H2
;(2)反应③的离子方程式为
3NO2+H2O═2H++2NO3-+NO
3NO2+H2O═2H++2NO3-+NO
.(3)Y和E在一定条件下可反应生成B和Z,这是一个具有实际意义的反应,可消除E对环境的污染,该反应的化学方程式为
4NH3+6NO
5N2+6H2O
| ||
| △ |
4NH3+6NO
5N2+6H2O
.
| ||
| △ |
(4)0.1mol/L的X溶液和0.1mol/L的Y溶液等体积混合,溶液呈
酸性
酸性
性;(填“酸”、“碱”或“中”)该溶液中各离子浓度大小关系为:c(Cl-)>c(NH4+)>c(H+)>c(OH-)
c(Cl-)>c(NH4+)>c(H+)>c(OH-)
.(5)常温下0.1mol/L的Y溶液中c(H+)/c(OH-)=1×10-8,下列叙述正确的是
ACD
ACD
A.该溶液的pH=11
B.该溶液中的溶质电离出的阳离子浓度0.1mol/L
C.该溶液中水电离出的c(H+)与c(OH-)乘积为1×10-22
D. pH=3的盐酸溶液V1 L与该0.1mol/L的Y溶液V2 L混合,若混合溶液pH=7,则:V1>V2
E.将pH=11的Y溶液加水稀释100倍后,pH值为9;
(6)化合物E在一定条件下于一定体积的容器中可发生身氧化还原反应,测得容器内气体的压强略小于原来的2/3,请写出该反应的化学方程式
3NO═NO2+N2O
3NO═NO2+N2O
.A、B、C、D、E、F 是六种短周期的主族元素,它们的原子序数依次递增;A元素与其它元素均不在同一周期,C元素与B、D元素同周期相邻;C元素的最高价氧化物对应水化物与C元素的气态氢化物X能相互反应生成盐Y;D、F元素同族,E是短周期主族中原子半径最大的元素.请完成下列问题:
(1)D位于元素周期表第 周期 族.
(2)E原子的结构示意图为 .
(3)D和F两元素相比较,非金属性较强的是 (填元素名称),可以验证该结论的事实是
(只写一个即可).
(4)A、D和E三种元素组成的化合物,其所含的化学键类型有 .
(5)检验X的试剂或试纸是 .
(6)由A、C、D三种元素组成的两种强电解质甲和乙,它们的水溶液均呈酸性.若甲抑制水的电离,则甲的化学式为 ;若乙促进水的电离,则乙的水溶液呈酸性的原因是(用离子方程式表示) .
(7)写出D、E两元素形成的原子个数比为1:1的化合物与水反应的化学方程式:
.
(8)A与D间可形成负一价双原子阴离子,有10个电子,写出该阴离子与盐酸反应的离子方程式
.
(9)已知0.4mol 液态C2 A4与液态双氧水反应,生成C2和液态水,放出327.2kJ的热量,该反应的热化学方程式为 .
(10)D、E、F简单离子半径由大到小的顺序为: (用离子符号表示).
(11)写出A、D两种元素形成的化合物的一种用途 .
查看习题详情和答案>>
(1)D位于元素周期表第
(2)E原子的结构示意图为
(3)D和F两元素相比较,非金属性较强的是
(4)A、D和E三种元素组成的化合物,其所含的化学键类型有
(5)检验X的试剂或试纸是
(6)由A、C、D三种元素组成的两种强电解质甲和乙,它们的水溶液均呈酸性.若甲抑制水的电离,则甲的化学式为
(7)写出D、E两元素形成的原子个数比为1:1的化合物与水反应的化学方程式:
(8)A与D间可形成负一价双原子阴离子,有10个电子,写出该阴离子与盐酸反应的离子方程式
(9)已知0.4mol 液态C2 A4与液态双氧水反应,生成C2和液态水,放出327.2kJ的热量,该反应的热化学方程式为
(10)D、E、F简单离子半径由大到小的顺序为:
(11)写出A、D两种元素形成的化合物的一种用途
A、B、C、D、E五种元素,A元素的周期数、主族数、原子序数相同;B的基态原子核外有3种能量不同的原子轨道,且每种轨道中的电子数相同;C元素的电离能如图所示;D元素的价电子构型为nsnnpn+2;E是第4周期的过渡金属元素,血红蛋白中的E元素与BD形成的配位键比与D2形成的配位键强.E单质与BD形成的配合物E(BD)5,常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂.

(1)E(BD) 5晶体属于 (填晶体类型).
(2)A元素和B元素组成的化合物分子之间 (填“有”或“没有”)形成氢键.
(3)基态E原子的电子排布式为 .
(4)B、C、D三种元素的电负性由大到小的顺序是 (填元素符号).
(5)C2和B2A2的分子中根据电子云重叠的方式不同,都包含的共价键类型有 .
(6)已知原子数和电子数相同的微粒叫等电子体,等电子体的结构相似.根据下表数据,说明BD分子比C2分子活泼的原因 .
查看习题详情和答案>>

(1)E(BD) 5晶体属于
(2)A元素和B元素组成的化合物分子之间
(3)基态E原子的电子排布式为
(4)B、C、D三种元素的电负性由大到小的顺序是
(5)C2和B2A2的分子中根据电子云重叠的方式不同,都包含的共价键类型有
(6)已知原子数和电子数相同的微粒叫等电子体,等电子体的结构相似.根据下表数据,说明BD分子比C2分子活泼的原因
| X-Y | X=Y | X≡Y | |
| BD的键能(kJ?mol-1) | 357.7 | 798.9 | 1071.9 |
| C2的键能(kJ?mol-1) | 154.8 | 418.4 | 941.7 |
A、B、C、D是短周期元素形成的四种气体单质。E、F均为气体,且F为红棕色。有关的转化关系如下图所示(反应条件均已略去)。

请回答下列问题:
(1)D的化学式为 ;
(2)反应③的离子方程式为 。
(3)Y和E在一定条件下可反应生成B和Z,这是一个具有实际意义的反应,可消除E对环境的污染,该反应的化学方程式为 。
(4)0.1mol/L的X溶液和0.1mol/L的Y溶液等体积混合,溶液呈________性;(填“酸”、“碱”或“中”)该溶液中各离子浓度大小关系为:_______________________
(5)常温下0.1mol/L的Y溶液中c(H+)/c(OH-)=110-8,下列叙述正确的是( )
A.该溶液的pH=11;
B.该溶液中的溶质电离出的阳离子浓度0.1mol/L
C.该溶液中水电离出的c(H+)与c(OH-)乘积为110-22
D. pH=3的盐酸溶液V1 L与该0.1mol/L的Y溶液V2 L混合,若混合溶液pH=7,则:V1>V2
E.将pH=11的Y溶液加水稀释100倍后,pH值为9;
(6)化合物E在一定条件下于一定体积的容器中可发生身氧化还原反应,测得容器内气体的压强略小于原来的2/3,请写出该反应的化学方程式
查看习题详情和答案>>