网址:http://m.1010jiajiao.com/timu3_id_190623[举报]
(1)NO2和N2的混合气体通入水中充分反应后,气体体积变为原体积的1/2, 求原混合气体中NO2和N2的体积比 。
(2)一定条件下,将等体积NO和O2的混合气体置于试管中,并将试管倒立在水槽中,充分反应后,剩余气体约占原气体总体积的 。
查看习题详情和答案>>
(1)NO2和N2的混合气体通入水中充分反应后,气体体积变为原体积的1/2, 求原混合气体中NO2和N2的体积比 。
(2)一定条件下,将等体积NO和O2的混合气体置于试管中,并将试管倒立在水槽中,充分反应后,剩余气体约占原气体总体积的 。
查看习题详情和答案>>
(1)一定条件下,向一个2L的密闭容器中充入2molN2和6molH2,反应达平衡时放出93kJ热量,生成NH3的浓度为1mol/L,试写出该反应的热化学方程式
(2)现有一支l0mL的试管,充满NO倒置于水槽中,向试管中缓缓通A-定量氧气,当试管内液面稳定时,剩余气体2mL.则通入氧气的体积可能为
(3)一定条件下,某密闭容器中发生反应:4NH3(g)+5O2g)?4NO(g)+6H2O(g).
| 起始浓度(mol. L-1) | c( NH3) | c( O2) | c( NO) | c( H20) |
| 甲 | 1 | 2 | 0 | 0 |
| 乙 | 2 | 4 | 0 | 0 |
| 丙 | 0.5 | x | y | z |
②恒温恒容下,若要使丙与甲平衡时各组分浓度相同,则x=
(4)向容积相同、温度分别为T1和T2的两个密闭容器中分别充入等量NO2,发生反应:2NO2(g)?N2O4(g)△H<0.恒温恒容下反应相同时间后,分别测定体系中NO2的百分含量分别为a1和a2;已知T1<T2,则a1
A.大于 B.小于 c.等于 D.以上都有可能
(5)标准状况下,将干燥纯净的氨和二氧化氮气体分别完成喷泉实验后所得溶液等体积混合,反应后溶液中的离子浓度关系正确的是
A.c(NO-3)>c(NH+4)>c(H+)>c(OH-)
B.c(NH+4)>c(NO-3)>c(OH-)>c(H+)
C.c(H+)=c(OH-)+c(NH3.H2O)
D.c(NH4+)+c(NH3.H2O)=1.5c(NO-3) 查看习题详情和答案>>
氮及其化合物与我们的吃、穿、住、行、健康等都有着密切的联系,也是高中化学学习中重要的一部分.请回答下列问题:
(1)一定条件下,向一个2L的密闭容器中充人2mo1N2和6molH2,反应达平衡时放出93kJ热量,生成NH3的浓度为1mol/L,试写出该反应的热化学方程式______.
(2)现有一支l0mL的试管,充满NO倒置于水槽中,向试管中缓缓通A-定量氧气,当试管内液面稳定时,剩余气体2mL.则通入氧气的体积可能为______.
(3)一定条件下,某密闭容器中发生反应:4NH3(g)+5O2g)?4NO(g)+6H2O(g).
| 起始浓度(mol. L-1) | c( NH3) | c( O2) | c( NO) | c( H20) |
| 甲 | 1 | 2 | 0 | 0 |
| 乙 | 2 | 4 | 0 | 0 |
| 丙 | 0.5 | x | y | z |
②恒温恒容下,若要使丙与甲平衡时各组分浓度相同,则x=______,y=______,z=______.
(4)向容积相同、温度分别为T1和T2的两个密闭容器中分别充入等量NO2,发生反应:2NO2(g)?N2O4(g)△H<0.恒温恒容下反应相同时间后,分别测定体系中NO2的百分含量分别为a1和a2;已知T1<T2,则a1______a2.
A.大于 B.小于 c.等于 D.以上都有可能
(5)标准状况下,将干燥纯净的氨和二氧化氮气体分别完成喷泉实验后所得溶液等体积混合,反应后溶液中的离子浓度关系正确的是______.
A.c(NO-3)>c(NH+4)>c(H+)>c(OH-)
B.c(NH+4)>c(NO-3)>c(OH-)>c(H+)
C.c(H+)=c(OH-)+c(NH3.H2O)
D.c(NH4+)+c(NH3.H2O)=1.5c(NO-3) 查看习题详情和答案>>
随着大气污染的日趋严重,“节能减排”,减少全球温室气体排放,研究NOx、SO2、CO等大气污染气体的处理具有重要意义。
(1)如图是在101 kPa、298 K条件下1 mol NO2和1 mol CO反应生成1 mol CO2和1 mol NO过程中能量变化示意图。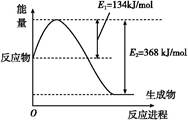
已知:N2(g)+O2(g) 2NO(g) ΔH="+179.5" kJ/mol
2NO(g) ΔH="+179.5" kJ/mol
2NO(g)+O2(g) 2NO2(g) ΔH="-112.3" kJ/mol
2NO2(g) ΔH="-112.3" kJ/mol
则在298 K时,反应:2NO(g)+2CO(g) N2(g)+2CO2(g)的ΔH= 。
N2(g)+2CO2(g)的ΔH= 。 
(2)将0.20 mol NO2和0.10 mol CO 充入一个容积恒定为1 L的密闭容器中发生反应,在不同条件下,反应过程中部分物质的浓度变化状况如图所示。
①下列说法正确的是 (填序号)。
a.容器内的压强不发生变化说明该反应达到平衡
b.当向容器中再充入0.20 mol NO时,平衡向正反应方向移动,K值增大
c.升高温度后,K值减小,NO2的转化率减小
d.向该容器内充入He气,反应物的体积减小,浓度增大,所以反应速率增大
②计算产物NO2在0~2 min时平均反应速率v(NO2)= mol/(L·min)。
③第4 min时改变的反应条件为 (填“升温”或“降温”)。
④计算反应在第6 min时的平衡常数K= 。若保持温度不变,此时再向容器中充入CO、NO各0.060 mol,平衡将 移动(填“正向”、“逆向”或“不”)。 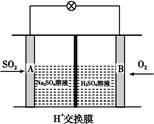
(3)有学者想以如图所示装置用原电池原理将SO2转化为重要的化工原料。其负极的反应式为 ,当有0.25 mol SO2被吸收,则通过质子(H+)交换膜的H+的物质的量为 。
(4)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9。现将2×10-4 mol/L的Na2CO3溶液与一定浓度的CaCl2溶液等体积混合生成沉淀,计算应加入CaCl2溶液的最小浓度为 。