网址:http://m.1010jiajiao.com/timu3_id_190145[举报]
H:0.1 |
|
|
|
|
|
|
Li:1.0 | Be:1.5 | B:2.0 | C:2.5 | N:3.0 | O:3.5 | F:4.0 |
Na:0.9 | Mg:1.2 | Al:1.5 | Si:1.8 | P:2.1 | S:2.5 | Cl:3.0 |
K:0.8 | Ca:1.0 | Ga:1.6 | Ge:1.8 | As:2.0 | Se:2.4 | Br:2.8 |
Rb:0.8 | Sr:1.0 | In:1.7 | Sn:1.8 | Sb:1.9 | Te:χ | I:2.5 |
Cs:0.7 | Ba:0.9 | Tl:1.8 | Pb:1.9 | Bi:1.9 | Po:2.0 | At:2.5 |
Fr:0.7 | Ra:0.9 |
|
|
|
|
|
回答下列问题:
(1)写出上述元素电负性在同周期或同主族中的递变规律(任定一种):___________________。
(2)预测Te元素χ的值为_________,它的非金属性比I元素_________ (选填“强”或“弱”)。
(3)你认为Linus Pauling提出电负性的概念是确定化合物中原子_________(选填“失电子”或“得电子”)能力的相对大小。
(4)大量事实表明,当两种元素的Χ值相差大于或等于1.7时,形成的化合物一般是离子化
合物,根据此经验规律,AlCl3中化学键的类型应该是_________。
1932年,美国化学大师Linus Pauling提出电负性(用希腊字母χ表示)的概念,用来确定化合物中原子某种能力的相对大小.Linus Pauling假定F的电负性为4,并通过热化学方法建立了其他元素的电负性.Linus Pauling建立的主族元素的电负性如下:
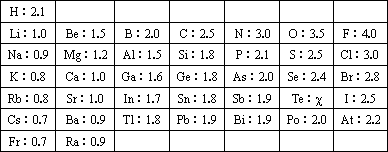
请仔细分析,回答下列问题:
(1)你认为Linus Pauling提出电负性的概念是确定化合物中原子哪种能力的相对大小?________________;
(2)预测Te元素χ的值________;
(3)根据表中所给数据分析研究推测:
同主族的不同元素的电负性变化的规律是________________,同周期中,电负性与原子半径的关系为________________________.
(4)一般认为,当两种成键元素的电负性差值小于1.7时,这两种元素通常形成共价化合物.根据H和F的电负性差值能否判断HF是离子化合物,并说明理由:________________________________.
(5)2005年1月美国科学家在《Science》上发表论文,宣布发现了Al的超原子结构Al13和Al14,并预言其它金属原子也可能存在类似的结构.这种超原子具有40个价电子(价电子即最外层电子)时最稳定.请预测Al14与周期表中________族元素的性质相似.
1932年,美国化学大师Linus Pauling提出电负性(用希腊字母χ表示)的概念,用来确定化合物中原子某种能力的相对大小。Linus Pauling假定F的电负性为4,并通过热化学方法建立了其他元素的电负性。LinusPauling建立的主族元素的电负性如下:
| H:2.1 |
|
|
|
|
|
|
| Li:1.0 | Be:1.5 | B:2.0 | C:2.5 | N:3.0 | O:3.5 | F:4.0 |
| Na:0.9 | Mg:1.2 | Al:1.5 | Si:1.8 | P:2.1 | S:2.5 | Cl:3.0 |
| K:0.8 | Ca:1.0 | Ga:1.6 | Ge:1.8 | As:2.0 | Se:2.4 | Br:2.8 |
| Rb:0.8 | Sr:1.0 | In:1.7 | Sn:1.8 | Sb:1.9 | Te:χ | I:2.5 |
| Cs:0.7 | Ba:0.9 | Tl:1.8 | Pb:1.9 | Bi:1.9 | Po:2.0 | At:2.2 |
| Fr:0.7 | Ra:0.9 |
|
|
|
|
|
回答下列问题:
⑴纵观各周期主族元素电负性变化,谈谈你对元素性质呈现周期性变化的理解: ;
⑵预测Te元素χ的值 ;
⑶你认为Linus Pauling提出电负性的概念是确定化合物中原子哪种能力的相对大小? ;
⑷大量事实表明,当两种元素的电负性差值小于1.7时,这两种元素通常形成共价化合物。用电子式表示AlBr3的形成过程 。
查看习题详情和答案>>
1932年,美国化学大师Linus Pauling提出电负性(用希腊字母χ表示)的概念,用来确定化合物中原子某种能力的相对大小。Linus Pauling假定F的电负性为4,并通过热化学方法建立了其他元素的电负性。Linus Pauling建立的主族元素的电负性如下:
| H:2.1 | | | | | | |
| Li:1.0 | Be:1.5 | B:2.0 | C:2.5 | N:3.0 | O:3.5 | F:4.0 |
| Na:0.9 | Mg:1.2 | Al:1.5 | Si:1.8 | P:2.1 | S:2.5 | Cl:3.0 |
| K:0.8 | Ca:1.0 | Ga:1.6 | Ge:1.8 | As:2.0 | Se:2.4 | Br:2.8 |
| Rb:0.8 | Sr:1.0 | In:1.7 | Sn:1.8 | Sb:1.9 | Te:χ | I:2.5 |
| Cs:0.7 | Ba:0.9 | Tl:1.8 | Pb:1.9 | Bi:1.9 | Po:2.0 | At:2.2 |
| Fr:0.7 | Ra:0.9 | | | | | |
回答下列问题:
⑴纵观各周期主族元素电负性变化,谈谈你对元素性质呈现周期性变化的理解: ;
⑵预测Te元素χ的值 ;
⑶你认为Linus Pauling提出电负性的概念是确定化合物中原子哪种能力的相对大小? ;
⑷大量事实表明,当两种元素的电负性差值小于1.7时,这两种元素通常形成共价化合物。用电子式表示AlBr3的形成过程 。 查看习题详情和答案>>
1932年,美国化学大师Linus Pauling提出电负性(用希腊字母χ表示)的概念,用来确定化合物中原子某种能力的相对大小。Linus Pauling假定F的电负性为4,并通过热化学方法建立了其他元素的电负性。Linus Pauling建立的主族元素的电负性如下:
|
H:2.1 |
|
|
|
|
|
|
|
Li:1.0 |
Be:1.5 |
B:2.0 |
C:2.5 |
N:3.0 |
O:3.5 |
F:4.0 |
|
Na:0.9 |
Mg:1.2 |
Al:1.5 |
Si:1.8 |
P:2.1 |
S:2.5 |
Cl:3.0 |
|
K:0.8 |
Ca:1.0 |
Ga:1.6 |
Ge:1.8 |
As:2.0 |
Se:2.4 |
Br:2.8 |
|
Rb:0.8 |
Sr:1.0 |
In:1.7 |
Sn:1.8 |
Sb:1.9 |
Te:χ |
I:2.5 |
|
Cs:0.7 |
Ba:0.9 |
Tl:1.8 |
Pb:1.9 |
Bi:1.9 |
Po:2.0 |
At:2.2 |
|
Fr:0.7 |
Ra:0.9 |
|
|
|
|
|
回答下列问题:
⑴纵观各周期主族元素电负性变化,谈谈你对元素性质呈现周期性变化的理解: ;
⑵预测Te元素χ的值 ;
⑶你认为Linus Pauling提出电负性的概念是确定化合物中原子哪种能力的相对大小? ;
⑷大量事实表明,当两种元素的电负性差值小于1.7时,这两种元素通常形成共价化合物。用电子式表示AlBr3的形成过程 。
查看习题详情和答案>>