摘要:18.下表为元素周期表的一部分.列出10种元素在元素周期表中的位置.用化学符号回答下列问题: 主族 周期 Ⅰ Ⅱ Ⅲ Ⅳ Ⅴ Ⅵ Ⅶ Ⅷ 2 ⑥ ⑦ 3 ① ③ ⑤ ⑧ ⑩ 4 ② ④ ⑨ (1)10种元素中化学性质最不活泼的是 . (2)①③⑤三种元素最高价氧化物对应的水化物中.碱性最强的是 . (3)①和⑨的最高价氧化物对应的水化物的化学式为 和 ,①和⑨两元素形成的化合物的化学式 .该化合物灼烧的焰色为 色,该化合物的溶液与元素⑧的单质反应的化学方程式为 . (4)⑥与⑧形成化合物的化学式为 ,单质⑨溶于该化合物所得溶液呈 色. (5)①⑤最高价氧化物对应水化物相互反应的离子方程式为 .
网址:http://m.1010jiajiao.com/timu3_id_189563[举报]
下表为元素周期表的一部分,列出10种元素在周期表中的位置。用化学符号回答下列问题:
|
|
IA |
IIA |
IIIA |
IVA |
VA |
VIA |
VIIA |
0 |
|
第2周期 |
|
|
|
⑥ |
|
⑦ |
|
|
|
第3周期 |
① |
③ |
⑤ |
|
|
|
⑧ |
⑩ |
|
第4周期 |
② |
④ |
|
|
|
|
⑨ |
|
(1)10种元素中,化学性质最不活泼的是________。
(2)①、③、⑤三种元素最高价氧化物对应的水化物中,碱性最强的是___。
(3)②、③、④三种元素形成的离子,离子半径由大到小的顺序是_____。
(4)元素⑦的氢化物的化学式为________;该氢化物常温下和元素⑧的单质反应的化学方程式为______________________。
(5)①和⑨两种元素形成化合物的化学式为______,该化合物燃烧时的焰色为______,该化合物溶液与元素⑧的单质反应的化学方程式为________________。
查看习题详情和答案>>
下表为元素周期表的一部分,列出10种元素在周期表中的位置。用化学符号回答下列问题

(1)10种元素中,化学性质最不活泼的是________。
(2)①、③、⑤三种元素最高价氧化物对应的水化物中,碱性最强的是_____________。
(3)②、③、④三种元素形成的离子,离子半径由大到小的顺序是_________________。
(4)元素⑦的氢化物的化学式为_____________;该氢化物常温下和元素⑧的单质反应的化学方程式为
______________________。
(5)①和⑨两种元素形成化合物的化学式为______,该化合物燃烧时的焰色为______,该化合物溶液与元素⑧的单质反应的化学方程式为________________。
查看习题详情和答案>>
(2)①、③、⑤三种元素最高价氧化物对应的水化物中,碱性最强的是_____________。
(3)②、③、④三种元素形成的离子,离子半径由大到小的顺序是_________________。
(4)元素⑦的氢化物的化学式为_____________;该氢化物常温下和元素⑧的单质反应的化学方程式为
______________________。
(5)①和⑨两种元素形成化合物的化学式为______,该化合物燃烧时的焰色为______,该化合物溶液与元素⑧的单质反应的化学方程式为________________。
(14)下表为元素周期表的一部分,列出了10种元素在元素周期表中的位置。试回答下列问题:
| ① | |||||||||||||||||
| ⑥ | ⑦ | ||||||||||||||||
| ② | ④ | ⑤ | ⑧ | ||||||||||||||
| ③ | ⑩ | ||||||||||||||||
| ⑨ | |||||||||||||||||
⑴②、③、④三种元素最高价氧化物的水化物的碱性由强到弱的顺序是________(填化学式)。
⑵10种元素中,原子半径最小的是________(填序号)。
⑶元素⑦的氢化物分别与②和⑧的单质反应的离子方程式为________
⑷元素②和⑤的最高价氧化物的水化物相互反应的化学方程式为________。
⑸元素⑩的原子序数为________,该元素在地壳中的含量居第四位,是目前应用最广泛的一种金属,其单质与⑧的氢化物的水溶液反应的离子方程式为________。
⑹⑥与⑧形成化合物的化学式为________;单质⑨溶于该化合物所得溶液呈________色。
 下表为元素周期表的一部分,已经列出①-⑩10种元素在周期表中的位置.请用化学符号回答下列问题:
下表为元素周期表的一部分,已经列出①-⑩10种元素在周期表中的位置.请用化学符号回答下列问题:| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | Ⅵ | ⅦA | 0 | |
| 第2周期 | ⑦ | |||||||
| 第3周期 | ① | ③ | ⑤ | ⑥ | ⑧ | ⑩ | ||
| 第4周期 | ② | ④ | ⑨ |
(1)10种元素中,化学性质最不活泼的是
Ar
Ar
.(2)①、③、⑤三种元素最高价氧化物对应的水化物中,碱性最强的是
NaOH
NaOH
.(3)②、③、④三种元素形成的离子,离子半径由大到小的顺序是
K+
K+
>Ca2+
Ca2+
>Mg2+
Mg2+
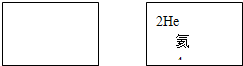
.(4)请在如图方框中按氦元素的式样写出元素⑥的原子序数、元素符号、元素名称、相对原子质量


(5)⑧和⑨两元素的核电荷数之差为
18
18
.下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
(1)④、⑤、⑥的原子半径由大到小的顺序为
(2)⑨、=10 ⑩的最高价含氧酸的酸性由强到弱的顺序是
(3)①、④、⑥中的某些元素可形成既含离子键又含共价键的化合物,写出其中一种化合物的电子式: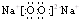
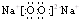 .
.
(4)由表中④、=10 ⑩两种元素形成的氢化物中沸点高的是
查看习题详情和答案>>
| 族 周期 |
IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | ① | |||||||
| 2 | ② | ③ | ④ | ⑤ | ||||
| 3 | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | |||
Na>O>F
Na>O>F
.(2)⑨、=10 ⑩的最高价含氧酸的酸性由强到弱的顺序是
H2SO4>H3PO4
H2SO4>H3PO4
.(3)①、④、⑥中的某些元素可形成既含离子键又含共价键的化合物,写出其中一种化合物的电子式:
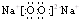
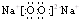
(4)由表中④、=10 ⑩两种元素形成的氢化物中沸点高的是
H2O
H2O
,说明原因:H2O分子间存在氢键
H2O分子间存在氢键
.