摘要:22.C12通人浓氨水发生反应:3Cl2+8NH396NH4Cl+N2现通人一定量的C12.反应后测得有3.40g的NH3被氧化. (1)参加反应的氧化剂与还原剂的物质的量之比为: , (2)该反应中电子转移的数目为 , (3)还原产物的质量为 .
网址:http://m.1010jiajiao.com/timu3_id_189360[举报]
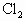 通入浓氨水发生反应:
通入浓氨水发生反应: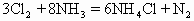 ,现通入10.65g
,现通入10.65g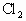 ,反应后测得有1.7g
,反应后测得有1.7g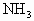 被氧化.
被氧化.
(1)写出参加反应的氧化剂与还原剂的分子个数比.
(2)标出反应中电子转移的方向和数目.
(3)计算还原产物的质量.
查看习题详情和答案>>下列应用化学学科研究物质性质的基本方法或所得结论中,不正确的是( )
查看习题详情和答案>>
| A.根据物质的元素组成,将纯净物分为单质和化合物 |
| B.通过钠、镁、铝与水反应的实验,比较三种单质的金属性 |
| C.根据冷的浓硫酸可以用铝质容器储存的事实,说明常温下铝不会与浓硫酸发生反应 |
| D.打开盛装浓氨水的试剂瓶塞,观察现象,了解氨的某些物理性质 |
下列应用化学学科研究物质性质的基本方法或所得结论中,不正确的是( )
A.根据物质的元素组成,将纯净物分为单质和化合物
B.通过钠、镁、铝与水反应的实验,比较三种单质的金属性
C.根据冷的浓硫酸可以用铝质容器储存的事实,说明常温下铝不会与浓硫酸发生反应
D.打开盛装浓氨水的试剂瓶塞,观察现象,了解氨的某些物理性质
查看习题详情和答案>>
A.根据物质的元素组成,将纯净物分为单质和化合物
B.通过钠、镁、铝与水反应的实验,比较三种单质的金属性
C.根据冷的浓硫酸可以用铝质容器储存的事实,说明常温下铝不会与浓硫酸发生反应
D.打开盛装浓氨水的试剂瓶塞,观察现象,了解氨的某些物理性质
查看习题详情和答案>>
I、物质A-G有下图所示转化关系(部分反应物、生成物没有列出)其中A为某金属矿的主要成分,经过一系列反应可得到B和C.单质C可与E的浓溶液发生反应,G为砖红色沉淀.

请回答下列问题
(1)写出下列物质的化学式:B
(2)工业上B制备D在
(3)反应②的化学方程式是
(4)将0.23molB和0.11mol氧气放入容积为1L的密闭容器中,发生反应①,在一定温度下,反应达到平衡,得到0.12molD,则反应的平衡常数K=
II、“蓝瓶子”实验中使用的亚甲基蓝(C16H18ClN3S?3H2O)是一种氧化还原型指示剂,其氧化型呈蓝色,还原型呈无色:
氧化型(蓝色)+ne- 还原型(无色)
还原型(无色)
将葡萄糖的碱性溶液放在锥形瓶中,滴加亚甲基蓝指示剂(蓝色),塞上瓶塞,溶液呈蓝色;静置一段时间,溶液褪色;振荡后,溶液又呈蓝色;再静置,又变无色;再振荡,又变蓝色…
(1)上述溶液由蓝色变无色的过程中,亚甲基蓝被
(2)上述溶液由无色变蓝色的过程中,亚甲基蓝被
查看习题详情和答案>>

请回答下列问题
(1)写出下列物质的化学式:B
SO2
SO2
EH2SO4
H2SO4
GCu2O
Cu2O
(2)工业上B制备D在
接触室
接触室
设备中进行.(3)反应②的化学方程式是
Cu+2H2SO4(浓)
CuSO4+SO2+2H2O
| ||
Cu+2H2SO4(浓)
CuSO4+SO2+2H2O
.
| ||
(4)将0.23molB和0.11mol氧气放入容积为1L的密闭容器中,发生反应①,在一定温度下,反应达到平衡,得到0.12molD,则反应的平衡常数K=
K=23.8
K=23.8
L?mol-1,若温度不变,再加入0.50mol氧气后重新达到平衡,平衡向右
向右
(填“向左”、“不变”、“向右”)移动,氧气的转化率降低
降低
,(填“升高”“不变”或“降低”),D的体积分数减小
减小
(填“增大”“不变”或“减小”)II、“蓝瓶子”实验中使用的亚甲基蓝(C16H18ClN3S?3H2O)是一种氧化还原型指示剂,其氧化型呈蓝色,还原型呈无色:
氧化型(蓝色)+ne-
 还原型(无色)
还原型(无色)将葡萄糖的碱性溶液放在锥形瓶中,滴加亚甲基蓝指示剂(蓝色),塞上瓶塞,溶液呈蓝色;静置一段时间,溶液褪色;振荡后,溶液又呈蓝色;再静置,又变无色;再振荡,又变蓝色…
(1)上述溶液由蓝色变无色的过程中,亚甲基蓝被
还原
还原
(填“氧化”或“还原”,下同),其中还原
还原
剂是葡萄糖
葡萄糖
(填物质名称).(2)上述溶液由无色变蓝色的过程中,亚甲基蓝被
氧化
氧化
(填“氧化”或“还原”,下同),其中氧化剂是氧气
氧气
(填物质名称).