网址:http://m.1010jiajiao.com/timu3_id_188936[举报]
SO2 、NO、NO2、CO都是污染大气的有害气体,对其进行回收利用是节能减排的重要课题。
(1)上述四种气体中直接排入空气时会引起酸雨的有__________(填化学式)。
(2)已知:2SO2(g)+ O2(g)=2SO3(g);△H=-196.6kJ/mol
O2(g)+2NO(g)=2NO2(g);△H=-113.0kJ/mol
①反应:NO2(g) +SO2(g)= SO3(g) +NO(g)的△H=_ kJ/mol。
②一定条件下,将NO2和SO2以体积比1:1置于恒温恒容的密闭容器中发生反应: NO2(g) +SO2(g)  SO3(g) +NO(g),
SO3(g) +NO(g),
下列不能说明反应达到平衡状态的是_____(填字母)。
a.体系压强保持不变
b.混合气体的颜色保持不变
c.NO的物质的量保持不变
d.每生成1molSO3的同时消耗1molNO2
(3)CO可用于合成甲醇,其反应的化学方程式为CO(g)+2H2(g)
 CH3OH(g)。在一容积可变的密闭容器中充有10molCO和20mol H2,在催化剂作用下发生反应生成甲醇。CO的平衡转化率(α)与温度(T)、压强(p)的关系如图所示。
CH3OH(g)。在一容积可变的密闭容器中充有10molCO和20mol H2,在催化剂作用下发生反应生成甲醇。CO的平衡转化率(α)与温度(T)、压强(p)的关系如图所示。

①上述合成甲醇的反应为______(填“放热”或“吸热”)反应。
②A、B、C三点的平衡常数KA、KB、KC的大小关系为___________。
③若达到平衡状态A时,容器的体积为10L,则在平衡状态B时容器的体积为_____L。
(4)某研究小组设计了如图所示的甲醇燃料电池装置。

①该电池工作时,OH-向______(填“a”或“b”)极移动。
②电池工作一段时间后,测得溶液的pH减小,则该电池总反应的离子方程式为__________________。
查看习题详情和答案>>
某校科技小组的同学们采集酸雨样品,每隔一段时间测定样品的pH,得到下列数据:
| 时间 | 开始 | 8h后 | 16h后 | 24h后 | 32h后 | 40h后 | 48h后 |
| pH | 5.0 | 4.8 | 4.5 | 4.3 | 4.2 | 4.0 | 4.0 |
(1)酸雨放置时,pH发生变好的主要原因为
(2)煤中含有游离态的硫,试写出它经过一系列变化最后变成酸雨主要成分的有关化学方程式.(空线不一定填满)
| ||
| ||
B.有A.B两种烃,它们的组成相同,都约含85.7%的碳,烃A对氢气的相对密度是28;烃B式量比空气的平均式量稍小,且最简式与A相同,烃A.B都能使溴的四氯化碳溶液褪色,根据以上实验事实计算并回答问题.
(1)推算A.B两烃的化学式.(推算步骤写在下面)
A
(2)A、B中
(3)写出B与溴的四氯化碳溶液反应的化学方程式:
完成下列填空:
(1)反应的平衡常数大,处理NO2的效率高.增大该反应平衡常数的措施有
(2)一定条件下上述反应在某体积固定的密闭容器中进行,能说明该反应已经达到平衡状态的是
a.c(NO2):c(NH3)=3:4 b.6v(NO2)=7v(N2)
c.容器内气体总压强不再变化 d.容器内气体密度不再变化
(3)若平衡时NO2和N2的浓度之比为m/n,保持其它条件不变,缩小反应容器的体积后达到新的平衡,此时NO2和N2的浓度之比
(4)某温度下,在一个容积为2升的反应容器内,上述反应2分钟后达到平衡,测得刚好有3mol电子发生转移,则在2分钟内NH3的平均反应速率为:v(NH3)=
CO2、SO2、NOx是对环境影响较大的气体,控制和治理CO2、SO2、NOx是解决温室效应、
减少酸雨和光化学烟雾的有效途径。
⑴ 有效“减碳”的手段之一是节能。下列制氢方法最节能的是 ▲ 。(填字母序号)
A.电解水制氢:2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
B.高温使水分解制氢:2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
C.太阳光催化分解水制氢:2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
D.天然气制氢:CH4+H2O![]() CO+3H2
CO+3H2
⑵ CO2可转化成有机物实现碳循环。在体积为1 L的密闭容器中,充入1 molCO2和3 mol H2,一定
条件下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH=-49.0 kJ/mol,测得CO2 和CH3OH(g)
CH3OH(g)+H2O(g) ΔH=-49.0 kJ/mol,测得CO2 和CH3OH(g)
的浓度随时间变化如下图所示。
①从3 min到10 min,v(H2)= ▲ mol·L-1·min-1。(保留2位有效数字)
 ②能说明上述反应达到平衡状态的是 ▲ (选填编号)。
②能说明上述反应达到平衡状态的是 ▲ (选填编号)。
A.反应中CO2与CH3OH的物质的量浓度相等
B.混合气体的密度不随时间的变化而变化
C.单位时间内每消耗3 mol H2,同时生成1 mol H2O
D.CO2的体积分数在混合气体中保持不变
⑶ 新型氨法烟气脱硫技术的化学原理是采用氨水吸收烟气中的SO2,再用一定量的磷酸与上述吸收产
物反应。该技术的优点除了能回收利用SO2外,还能得到一种正盐作为复合肥料。该复合肥料的化
 学式为 ▲ 。
学式为 ▲ 。
⑷ 在汽车上安装三效催化转化器,可使汽车尾气中的主要污染物(CO、
NOx、碳氢化合物)进行相互反应,生成无毒物质,减少汽车尾气污染。某研究性学习小组探究某种催化剂在不同空燃比(空气与燃油气的质量比)条件下对汽车尾气的催化效果。在一定条件下,测得尾气中的主要污染物的转化率与空燃比的关系如右图所示。空燃比约为 ▲ 时,催化剂对汽车尾气的催化效果最好。(填a、b、c、d)
查看习题详情和答案>>Ⅰ.最近有科学家提出构想:把空气吹入饱和碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应后使之变为可再生燃料甲醇.该构想技术流程如下:
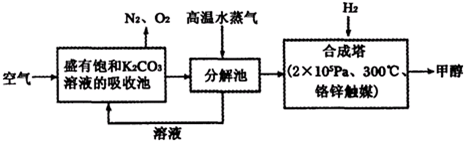
(1)向分解池中通入高温水蒸气的作用是
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-1275.6kJ/mol
②2CO(g)+O2(g)=2CO2(g)△H=-566.0kJ/mol
③H2O(g)=H2O(1)△H=-44.0kJ/mol
则甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为
Ⅱ.一氧化碳与氢气也可以合成甲醇,反应为CO(g)+2H2(g)?CH3OH(g)△H<0.
(1)某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分反应达到平衡,测得c(H2)=2.2mol?L-1,则CO的转化率为
(2)T1℃时,此反应的平衡常数为K(T1)=50.此温度下,在一个2L的密闭容器中加入一定量CO和H2,反应到某时刻测得各组分的浓度如下:
| 物质 | H2 | CO | CH3OH |
| 浓度/(mol?L-1) | 0.2 | 0.2 | 0.4 |
②若其他条件不变时,只改变反应的某一个条件,下列说法正确的是
A.若达到新平衡时c(CO)=0.3mol/L,平衡一定逆向移动
B.若将容器体积缩小到原来的一半,达到新平衡时,0.2mol/L<c(CO)<0.4mol/L
C.若向容器中同时加入0.4mol CO和0.8mol CH3OH(g),平衡不移动
D.若升高温度,平衡常数将增大
Ⅲ.CO2和SO2的处理是许多科学家都在着力研究的重点.有学者想以如图所示装置用燃料电池原理将CO2、SO2转化为重要的化工原料.
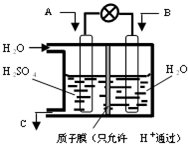
(1)若A为CO2,B为H2,C为CH3OH,电池总反应式为CO2+3H2=CH3OH+H2O,则正极反应式为
(2)若A为SO2,B为O2,C为H2SO4,则负极反应式为