摘要:4. 对于放热反应H2 + Cl2 2HCl.下列说法正确的是: A.1molH2所具有的总能量高于2molHCl所具有的总能量. B.反应物所具有的总能量高于产物所具有的总能量 C.断开1mol H-H键和1mol Cl-Cl键所吸收的总能量大于形成 2mol H-Cl键所放出的能量 D.该反应中.化学能只有转变为热能
网址:http://m.1010jiajiao.com/timu3_id_188884[举报]
下列说法正确的是( )
A.如图可表示水分解过程中的能量变化
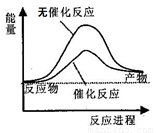
B.若2C(s)+O2(g)=2CO(g) △H=-221.0 kJ/mol,则碳的燃烧热为110.5 kJ/mol
C.需要加热的反应一定是吸热反应,常温下能发生的反应一定是放热反应
D.已知:Ⅰ:对于反应:H2(g)+Cl2(s)=2HCl (g) △H=- a kJ/mol,
Ⅱ: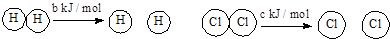
且a、b、c均大于零,则断开1molH-Cl键所需的能量为- a-b-c
查看习题详情和答案>>
下列说法正确的是
A.右图可表示水分解过程中的能量变化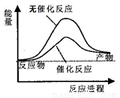
B.若2C(s)+O2(g)=2CO(g) △H= -221.0 kJ/mol,则碳的燃烧热为110.5 kJ/mol
C.需要加热的反应一定是吸热反应,常温下能发生的反应一定是放热反应
D.已知:Ⅰ:对于反应:H2(g)+Cl2(s)=2HCl (g) △H= - a kJ/mol,
Ⅱ: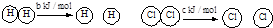
且a、b、c均大于零,则断开1 mol H-Cl键所需的能量为- a-b-c kJ
查看习题详情和答案>>
下列说法正确的是( )
A.如图可表示水分解过程中的能量变化 |
| B.若2C(s)+O2(g)=2CO(g)△H="-221.0" kJ/mol,则碳的燃烧热为110.5 kJ/mol |
| C.需要加热的反应一定是吸热反应,常温下能发生的反应一定是放热反应 |
| D.已知:Ⅰ:对于反应:H2(g)+Cl2(s)="2HCl" (g)△H="-" a kJ/mol, |

且a、b、c均大于零,则断开1molH-Cl键所需的能量为- a-b-c 查看习题详情和答案>>
下列说法正确的是
A.右图可表示水分解过程中的能量变化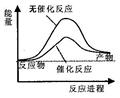 |
| B.若2C(s)+O2(g)=2CO(g)△H=" -221.0" kJ/mol,则碳的燃烧热为110.5 kJ/mol |
| C.需要加热的反应一定是吸热反应,常温下能发生的反应一定是放热反应 |
| D.已知:Ⅰ:对于反应:H2(g)+Cl2(s)="2HCl" (g)△H=" -" a kJ/mol, |

且a、b、c均大于零,则断开1 mol H-Cl键所需的能量为- a-b-c kJ 查看习题详情和答案>>

