网址:http://m.1010jiajiao.com/timu3_id_188366[举报]
 在一定条件下发生化学反应:2SO2(g)+O2(g)?2SO3(g)△H=-197kJ/mol.现有容积均为1L的甲、乙两个容器,在上述条件下分别充入气体,到达平衡时,反应放出的热(Q),及平衡时的转化率(X)如下表所示:
在一定条件下发生化学反应:2SO2(g)+O2(g)?2SO3(g)△H=-197kJ/mol.现有容积均为1L的甲、乙两个容器,在上述条件下分别充入气体,到达平衡时,反应放出的热(Q),及平衡时的转化率(X)如下表所示:| 容器 | 起始时各物质的量 | 到达平衡时放出的热量(QkJ) | 平衡时SO2转化率 (X) | |||
| SO2 | O2 | SO3 | N2 | |||
| 甲 | 2 | 1 | 0 | 0 | Q1 | X1 |
| 乙 | 1 | 0.5 | 0 | 1 | Q2= 39.4 |
X2 |
a、Q2<Q1<197kJ b、X2<X1<100% c、Q1=78.8 d、X1=2X2
(2)某时刻甲容器内反应达到平衡,保持恒温恒容;
①假设又向容器内加入一定量的SO2气体,则X(SO2)
②假设又向容器中加入一定量的SO3(g),X(SO2)
(3)平衡时,乙容器中SO2的体积分数为
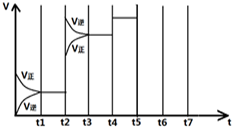
(4)如图表示某一时间段中该反应反应速率与反应过程的关系(t2、t4、t5)时刻改变的条件都只有一个).
①t2时改变的条件是
②若t 5时降低压强,试画出v-t图象③若各阶段对应的平衡常数如图所示
| t 1-t 2 | t 3-t 4 | t 4-t 5 | t 6-t 7 |
| K1 | K2 | K3 | K4 |
| 容器 | 起始时各物质的量 | 到达平衡时放出的热量(QkJ) | 平衡时SO2转化率 (X) | |||
| SO2(mol) | O2(mol) | SO3(mol) | N2 | |||
| 甲 | 2 | 1 | 0 | 0 | Q1 | X1 |
| 乙 | 1 | 0.5 | 0 | 0 | Q2=39.4 | X2 |
| 丙 | 1 | 0.5 | 0 | 1 | Q3 | X3 |
| 丁 | 1.8 | 0.9 | 0.2 | 0 | Q4 | X4 |
a、2Q3=2Q2<Q1<197kJ b、2X3=2X2<X1<100%
c、Q1>Q4 且 X1>X4 d、SO3的质量m:m甲=m丁>2m乙
e、容器内压强p:p甲=p丁>2p乙 f、c(SO2)与c(O2)之比k:k甲=k丙>k乙
h、若乙的体积为2L,则到达平衡时放出的热量小于39.4kJ
(2)某时刻甲容器内反应达到平衡,保持恒温恒容;
①假设又向容器内加入一定量的SO2气体,则X(SO2)
②假设又向容器中加入一定量的SO3(g),X(SO2)
(3)平衡时,乙容器中SO2的体积分数为
(4)如图表示某一时间段中该反应反应速率与反应过程的关系(t2、t4、t5)时刻改变的条件都只有一个).

①t2时改变的条件是
②若t5时降低压强,试画出t-v图象
③若各阶段对应的平衡常数如图所示
| t1-t2 | t3-t4 | t4-t5 | t6-t7 |
| K1 | K2 | K3 | K4 |
国家拟于“十二五”期间将SO2的排放量减少8%,研究SO2综合利用意义重大。
(1)已知25℃时:SO2(g)+2CO(g)=2CO2(g)+ Sx(s) △H=akJ/mol
Sx(s) △H=akJ/mol
2COS(g)+SO2(g)=2CO2(g)+ Sx(s) △H=bkJ/mol。
Sx(s) △H=bkJ/mol。
则CO与Sx生成COS反应的热化学方程式是________________________。
(2)有人设想按如图所示装置用废气中的SO2生产硫酸。

写出SO2电极的电极反应式__________________________。
(3)提高反应2SO2(g)+O2(g)
 2SO3(g) △H<0中SO2的转化率是控制SO2排放的关键措施之一。某课外活动小组进行了如下探究:
2SO3(g) △H<0中SO2的转化率是控制SO2排放的关键措施之一。某课外活动小组进行了如下探究:
①T1温度时,在2L的密闭容器中加入4.0molSO2和2.0molO2,5 min后反应达到平衡,二氧化硫的转化率为50%,前5 min内SO2的平均反应速率为___________。
②在①中的反应达到平衡后,改变下列条件,能使SO2的转化率及SO3的平衡浓度都比原来增大的是
_________(填序号)。
a.温度和容器体积不变,充入1.0molHe (g)
b.温度和容器体积不变,充入2molSO2和lmolO2
c.温度和容器体积不变,充入1.0molSO2
d.在其他条件不变时,减小容器的容积
③在其他条件不变的情况下,探究起始时氧气物质的量对2SO2(g)+O2(g)
 2SO3(g)反应的影响,实验结果如图所示。(图中T表示温度,n表示物质的量):在a、b、c三点所处的平衡状态中,SO2的转化率最高的是____,温度T1______T2(填“>”“<”或“=”)。
2SO3(g)反应的影响,实验结果如图所示。(图中T表示温度,n表示物质的量):在a、b、c三点所处的平衡状态中,SO2的转化率最高的是____,温度T1______T2(填“>”“<”或“=”)。

查看习题详情和答案>>