摘要:1.我们知道.大海是一个巨大的宝藏.海水中蕴含的元素有80多种.其中被称之为海洋元素的是 A.钠 B.氯 C.溴 D.碘
网址:http://m.1010jiajiao.com/timu3_id_186692[举报]
浩瀚的海洋是一个巨大的宝库,蕴含有80多种元素,可供提取利用的有50多种.
(1)其中“氯碱工业”就是以食盐水为原料制取Cl2等物质,有关的化学方程式为: .
(2)实验室用二氧化锰制取氯气的化学方程式为: ;根据上述实验原理,从下列装置中选择合适的发生装置用于实验室制取少量氯气 (填写装置的序号).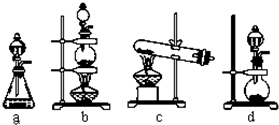
(3)实验室中模拟Br-→Br2的转化,可以通过在KBr溶液中滴加少量新制氯水的实验进行实现.写出Br-→Br2的转化离子方程式为: ;氯水不稳定,要现用现配,下列吸收氯气制备氯水的装置最合理的是 (选填下列选项的编号字母).
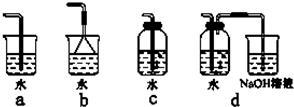
(4)实验室制备氯气的反应会因盐酸浓度下降而停止.为测定反应残余液中盐酸的浓度,探究小组同学进行了以下实验:取100mL残余液放入烧杯中,将烧杯(含玻璃棒)放在电子天平上(如下图),再把已称好50.0g CaCO3粉末慢慢加入到残余液中,边加边搅拌使其充分反应.观察读数变化如下表所示:

请你据此分析计算:
①实验中产生的CO2气体质量为 ;
②残余液中盐酸的物质的量浓度为(结果精确到小数点后一位) .
查看习题详情和答案>>
(1)其中“氯碱工业”就是以食盐水为原料制取Cl2等物质,有关的化学方程式为:
(2)实验室用二氧化锰制取氯气的化学方程式为:

(3)实验室中模拟Br-→Br2的转化,可以通过在KBr溶液中滴加少量新制氯水的实验进行实现.写出Br-→Br2的转化离子方程式为:

(4)实验室制备氯气的反应会因盐酸浓度下降而停止.为测定反应残余液中盐酸的浓度,探究小组同学进行了以下实验:取100mL残余液放入烧杯中,将烧杯(含玻璃棒)放在电子天平上(如下图),再把已称好50.0g CaCO3粉末慢慢加入到残余液中,边加边搅拌使其充分反应.观察读数变化如下表所示:

| CaCO3用量 | 未加CaCO3时 | 加约四分之一时 | 加一半时 | 全部加完时 |
| 读数/g | 318.3 | 325.3 | 334.5 | 359.5 |
①实验中产生的CO2气体质量为
②残余液中盐酸的物质的量浓度为(结果精确到小数点后一位)
海水是一个巨大的化学资源库,下列有关海水综合利用的说法正确的是( )
| A、海水中含有钾元素,只需经过物理变化就可以得到钾单质 | B、海水蒸发制海盐的过程中只发生了化学变化 | C、从海水中可以得到NaCl,电解熔融NaCl可制备Cl2 | D、利用潮汐发电是将机械能转化为电能 |
 (2009?肇庆一模)海水是一个巨大的化学资源库,下列有关海水综合利用的说法正确的是( )
(2009?肇庆一模)海水是一个巨大的化学资源库,下列有关海水综合利用的说法正确的是( )