摘要:氯碱工业的产品涉及国计民生的各个方面.其反应的原理为: .
网址:http://m.1010jiajiao.com/timu3_id_186235[举报]
如图表示各物质之间的转化关系。已知D、E、Z是中学化学常见的单质,其他都是化合物。Z、Y是氯碱工业的产品。D元素的原子最外层电子数与电子层数相等,且D的硫酸盐可作净水剂。E为日常生活中应用最广泛的金属。除反应①外,其他反应均在水溶液中进行。请回答下列问题。

(1)写出X的电子式:??????????? 。
(2)常温时pH =12的G溶液中,溶质的阳离子与溶质的阴离子浓度之差为?????????? (写出计算式)。
(3)在电镀工业中,若将E作为待镀金属,铜为镀层金属,则铜是____极,请写出在E电极上发生的电极反应式:????????????? 。
(4)写出反应③的离子方程式:??????????????????? 。
(5)现有无标签的Y和M的两种无色水溶液,不用其他任何试剂,请你设计一个简单的实验对这两种溶液加以鉴别???????????????? (回答实验操作、现象及结论)。
(6)A溶液与NaOH溶液混合可形成沉淀,某温度下此沉淀的Ksp =2.097×l0-39。将0.01 mol/L的A溶液与0.001 mol·L-1的NaOH溶液等体积混合,你认为能否形成沉淀____(填“能”或“不能”),请通过计算说明????????????????????????????? 。
查看习题详情和答案>>
(2010?扬州模拟)氯碱工业的原料饱和食盐水中含有一定量的铵根离子,在电解时会生成性质极不稳定的三氯化氮,容易引起爆炸.
(1)三氯化氮易水解,其水解的最初产物除生成氨气外,另一产物为
(2)为除去饱和食盐水中的铵根离子,可在碱性条件下通入氯气,反应生成氮气.该反应的离子方程式为
(3)过量氯气用Na2S2O3除去,反应中S2O32-被氧化为SO42-.若过量的氯气为10-3mol/L,则理论上生成的SO42-为
(4)生产和实验中广泛采用甲醛法测定样品的含氮量.甲醛和铵根离子的反应如下:4NH4++6HCHO=(CH2)6N4H+(一元酸)+3H++6H2O.
实验步骤如下:
①甲醛中常含有微量甲酸,应先除去.可取甲醛b mL于锥形瓶,加入1滴酚酞,用浓度为C mol/L的NaOH溶液中和,滴定管的初始读数V1 mL,当溶液呈微红色时,滴定管的读数V2 mL.
②向其中加入饱和食盐水试样a mL,静置1分钟.
③再加1~2滴酚酞,再用上述NaOH溶液滴定至微红色,滴定管的读数V3 mL.则饱和食盐水中的含氮量为
mg/L.
查看习题详情和答案>>
(1)三氯化氮易水解,其水解的最初产物除生成氨气外,另一产物为
HClO
HClO
.(2)为除去饱和食盐水中的铵根离子,可在碱性条件下通入氯气,反应生成氮气.该反应的离子方程式为
3Cl2+2NH4++8OH-═N2↑+6Cl-+8H2O
3Cl2+2NH4++8OH-═N2↑+6Cl-+8H2O
.该工艺选择氯气的优点是利用氯碱工业的产品氯气为原料,就近取材,不引入其他杂质离子
利用氯碱工业的产品氯气为原料,就近取材,不引入其他杂质离子
.(答一点即可)(3)过量氯气用Na2S2O3除去,反应中S2O32-被氧化为SO42-.若过量的氯气为10-3mol/L,则理论上生成的SO42-为
5×10-4
5×10-4
mol/L.(4)生产和实验中广泛采用甲醛法测定样品的含氮量.甲醛和铵根离子的反应如下:4NH4++6HCHO=(CH2)6N4H+(一元酸)+3H++6H2O.
实验步骤如下:
①甲醛中常含有微量甲酸,应先除去.可取甲醛b mL于锥形瓶,加入1滴酚酞,用浓度为C mol/L的NaOH溶液中和,滴定管的初始读数V1 mL,当溶液呈微红色时,滴定管的读数V2 mL.
②向其中加入饱和食盐水试样a mL,静置1分钟.
③再加1~2滴酚酞,再用上述NaOH溶液滴定至微红色,滴定管的读数V3 mL.则饱和食盐水中的含氮量为
| 14000C(V3-V2) |
| a |
| 14000C(V3-V2) |
| a |
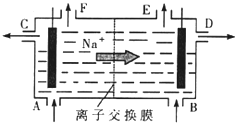 [化学选修2-化学与技术]我国氯碱工业迅速发展,产量已跃居世界首位,并培植了精细化工“产品树”.
[化学选修2-化学与技术]我国氯碱工业迅速发展,产量已跃居世界首位,并培植了精细化工“产品树”.(1)如图是离子交换膜法电解饱和食盐水的原理示意图.电解槽中B处加入的水中通常含有少量
(2)已知一个电子的电量是1.602×10-19C,若在离子膜电解饱和食盐水时通过电量1.929×105C,则产生NaOH
(3)利用氯碱工业产生的氢气和氯气可以将粗硅制成高纯硅,写出反应的化学方程式
(4)氯碱工业常用于电石法生产聚氯乙烯.请写出以电石和氯碱工业的产品为原料制备聚氯乙烯的化学方程式:①CaC2+2H2O→Ca(OH)2+C2 H2↑,②
 A、B、C、D都是中学化学中常见物质,其中A、B、C均含有同一种元素,在一定条件下相互转化关系如右(部分反应中的水已略去).
A、B、C、D都是中学化学中常见物质,其中A、B、C均含有同一种元素,在一定条件下相互转化关系如右(部分反应中的水已略去).(1)若A为氯碱工业的产品,C为厨房中的用品.
①D的电子式是


②反应Ⅲ的离子方程式是
HCO3-+OH-=H2O+CO32-
HCO3-+OH-=H2O+CO32-
.③氯碱工业制备A的化学方程式是
2NaCl+2H2
2NaOH+H2↑+Cl2↑
| ||
2NaCl+2H2
2NaOH+H2↑+Cl2↑
,其中两种产物可与KI溶液反应制得一种化工原料,若消耗0.1mol KI转移电子0.6mol,则三种物质间反应的离子方程式是
| ||
3Cl2+6OH-+I-=6Cl-+IO3-+3H2O
3Cl2+6OH-+I-=6Cl-+IO3-+3H2O
.(2)若A、D均为单质,且A为气体,D元素的一种红棕色氧化物常用作颜料.
①反应Ⅲ的离子方程式是
Cl2+2Fe2+=2Cl-+2Fe3+
Cl2+2Fe2+=2Cl-+2Fe3+
.②B可作净水剂,在使用时发现B不能使酸性废水中的悬浮物沉降除去,其原因是
Fe3++3H2O Fe(OH)3+3H+,酸性条件抑制了Fe3+的水解,不能生成Fe(OH)3胶体
Fe(OH)3+3H+,酸性条件抑制了Fe3+的水解,不能生成Fe(OH)3胶体
 Fe(OH)3+3H+,酸性条件抑制了Fe3+的水解,不能生成Fe(OH)3胶体
Fe(OH)3+3H+,酸性条件抑制了Fe3+的水解,不能生成Fe(OH)3胶体Fe3++3H2O Fe(OH)3+3H+,酸性条件抑制了Fe3+的水解,不能生成Fe(OH)3胶体
Fe(OH)3+3H+,酸性条件抑制了Fe3+的水解,不能生成Fe(OH)3胶体
. Fe(OH)3+3H+,酸性条件抑制了Fe3+的水解,不能生成Fe(OH)3胶体
Fe(OH)3+3H+,酸性条件抑制了Fe3+的水解,不能生成Fe(OH)3胶体(2012?河西区一模)下图中D、E、Z是单质,其余均是化合物.且知D、E为日常常用金属;D元素的原子最外层电子数与电子层数相等{无色气体N在Z中燃烧生成气体X;N、Z、Y是氯碱工业的产品;除反应①外,其他反应均在水溶液中进行.

请按要求回答下列问题:
(1)D在周期表中的位置:
 .
.
(2)G可做净水剂助剂,能加快悬浮物固体的沉降,请用离子方程式表示其原因:
(3)写出反应①的化学方程式:
(4)上图反应中不属于氧化还原反应的是(填编号)
(5)向含有0.2mol A和0.2mol X的混合溶液中,逐渐加入E粉末至过量(假设E与A完全反应后,再与X反应).请在坐标系中画出n(B)随n(E)变化的示意图:

查看习题详情和答案>>

请按要求回答下列问题:
(1)D在周期表中的位置:
第三周期,第ⅢA族
第三周期,第ⅢA族
;X的电子式为

(2)G可做净水剂助剂,能加快悬浮物固体的沉降,请用离子方程式表示其原因:
AlO2-+2H2O=Al(OH)3胶体+OH-
AlO2-+2H2O=Al(OH)3胶体+OH-
.(3)写出反应①的化学方程式:
2Al+3FeO
Al2O3+3Fe
| ||
2Al+3FeO
Al2O3+3Fe
.在B溶液中滴加黄色K3[Fe(CN)6]溶液,可观察到的现象是
| ||
生成有特征蓝色的沉淀
生成有特征蓝色的沉淀
.(4)上图反应中不属于氧化还原反应的是(填编号)
④⑦⑧⑨
④⑦⑧⑨
.(5)向含有0.2mol A和0.2mol X的混合溶液中,逐渐加入E粉末至过量(假设E与A完全反应后,再与X反应).请在坐标系中画出n(B)随n(E)变化的示意图:
