摘要:16.C 解析:A.Cu-4HNO3(浓)-Cu(NO3)2-2NO2 B.Cu-HNO3(稀)-Cu(NO3)2-NO C.CuO-2HNO3-Cu(NO3)2-H2O 由以上关系式可以看出:C.既节约原料.同时又不产生有毒气体.D.成本太高亦不可采用.故C为最好的办法.
网址:http://m.1010jiajiao.com/timu3_id_185994[举报]
(2012?房山区二模)一学习小组利用下图所示装置,对某含少量Fe的废铜屑进行铜含量的测定,并探究利用其制备硫酸铜溶液.
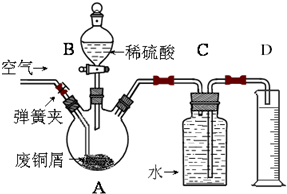
(1)向A中加入10g废铜屑样品,关闭弹簧夹,打开B活塞向A注入足量稀硫酸后关闭.此时装置C中发生的现象是
(2)反应进行到A中不再产生气泡时,若C中收集到448mL(已换算成标准状况)气体,则该废铜屑中铜的质量百分含量为
(3)拆除C、D装置后,打开弹簧夹,持续将空气通入A中,至A中固体全部消失,再继续通入一段时间空气后,关闭弹簧夹,停止通入空气.
①该过程中发生反应的离子方程式是
②为使A中固体加快溶解速率,以下方法运用合理的是
a.对A装置加热 b.向A内加入少量Fe2O3 c.向A内加入少量CuO
d.增大空气通入量 e.向A内加入少量FeSO4 f.向A内加入少量H2O
(4)将A中溶液倒入烧杯内,加入Cu2(OH)2CO3将其调节至pH=4时,溶液中铁被完全沉淀,过滤后即得红褐色沉淀与硫酸铜溶液,此过程离子反应方程式是
(5)有同学认为,可以不用测量气体法计算废铜屑中铜的质量百分含量,则其采用的方法是
查看习题详情和答案>>

(1)向A中加入10g废铜屑样品,关闭弹簧夹,打开B活塞向A注入足量稀硫酸后关闭.此时装置C中发生的现象是
水面下降,水顺长导管排入D中
水面下降,水顺长导管排入D中
.(2)反应进行到A中不再产生气泡时,若C中收集到448mL(已换算成标准状况)气体,则该废铜屑中铜的质量百分含量为
88.8%
88.8%
.(3)拆除C、D装置后,打开弹簧夹,持续将空气通入A中,至A中固体全部消失,再继续通入一段时间空气后,关闭弹簧夹,停止通入空气.
①该过程中发生反应的离子方程式是
4Fe2++O2+4H+=4Fe3++2H2O
4Fe2++O2+4H+=4Fe3++2H2O
、2Fe3++Cu=2Fe2++Cu2+
2Fe3++Cu=2Fe2++Cu2+
;②为使A中固体加快溶解速率,以下方法运用合理的是
abde
abde
.a.对A装置加热 b.向A内加入少量Fe2O3 c.向A内加入少量CuO
d.增大空气通入量 e.向A内加入少量FeSO4 f.向A内加入少量H2O
(4)将A中溶液倒入烧杯内,加入Cu2(OH)2CO3将其调节至pH=4时,溶液中铁被完全沉淀,过滤后即得红褐色沉淀与硫酸铜溶液,此过程离子反应方程式是
Cu2(OH)2CO3+H++Fe3+=2Cu2++Fe(OH)3↓+CO2↑
Cu2(OH)2CO3+H++Fe3+=2Cu2++Fe(OH)3↓+CO2↑
.(5)有同学认为,可以不用测量气体法计算废铜屑中铜的质量百分含量,则其采用的方法是
测定沉淀法
测定沉淀法
,其具体操作步骤可续写为:将(4)中所得红褐色沉淀洗涤、干燥、称量、计算
将(4)中所得红褐色沉淀洗涤、干燥、称量、计算
. 超细铜粉主要应用于导电材料、催化剂等领域中.超细铜粉的某制备方法如下:
超细铜粉主要应用于导电材料、催化剂等领域中.超细铜粉的某制备方法如下:
试回答下列问题:
(1)下列关于[Cu(NH3)4]SO4的说法中,正确的有
AD
AD
.(填字母序号)A.[Cu(NH3)4]SO4中所含的化学键有离子键、极性键和配位键
B.[Cu(NH3)4]SO4含有NH3分子,其水溶液中也含有NH3分子
C.[Cu(NH3)4]SO4的组成元素中第一电离能最大的是氧元素
D.[Cu(NH3)4]SO4的外界离子的空间构型为正四面体
(2)NH4CuSO3中的金属阳离子的核外电子排布式为:
[Ar]3d10
[Ar]3d10
.(3)SO
2- 3 |
sp3
sp3
,与其互为等电子体的一种分子的分子式是NF3(或PF3、NCl3、PCl3等)
NF3(或PF3、NCl3、PCl3等)
.(4)NH3易液化的原因是
NH3分子间可形成氢键
NH3分子间可形成氢键
.(5)如图是铜的某种氧化物的晶胞结构示意图,由此可确定该氧化物的化学式为
CuO
CuO
.(6)NH4CuSO3与硫酸微热时除得到超细铜粉外,还可看到溶液变蓝,同时有使品红褪色的气体.则该反应的离子方程式为
2NH4CuSO3 +4H+
2NH4++Cu2++Cu+2SO2↑+2H2O
| ||
2NH4CuSO3 +4H+
2NH4++Cu2++Cu+2SO2↑+2H2O
.
| ||
非金属单质A经如图所示的过程转化为含氧酸D,已知D为强酸,请回答下列问题.

(1)若A在常温下为固体,B是能使品红溶液褪色的有刺激性气味的无色气体.
①A、C、D的化学式分别是:A:
②写出A→B的化学方程式:
(2)若A在空气中的主要成分,C是红棕色的气体.
①A、C的化学式分别是:A
②写出B→C的化学方程式:
③D的浓溶液在常温下可与铜反应并生成C气体,请写出该反应的离子方程式
查看习题详情和答案>>

(1)若A在常温下为固体,B是能使品红溶液褪色的有刺激性气味的无色气体.
①A、C、D的化学式分别是:A:
S
S
;C:SO3
SO3
;D:H2SO4
H2SO4
.②写出A→B的化学方程式:
S+O2
SO2
| ||
S+O2
SO2
.
| ||
(2)若A在空气中的主要成分,C是红棕色的气体.
①A、C的化学式分别是:A
N2
N2
;CNO2
NO2
.②写出B→C的化学方程式:
2NO+O2=2NO2
2NO+O2=2NO2
.③D的浓溶液在常温下可与铜反应并生成C气体,请写出该反应的离子方程式
Cu+4H++2NO3-=Cu2++2NO2↑+2H2O
Cu+4H++2NO3-=Cu2++2NO2↑+2H2O
.该反应属于
属于
(填“属于”或“不属于”)氧化还原反应.已知在pH为4-5的环境中,Cu2+几乎不水解,而Fe3+几乎完全水解.某学生欲用电解纯净的CuSO4溶液的方法,根据电极上析出铜的质量以及电极上产生气体的体积来测定铜的相对原子质量.其实验过程如下图所示:
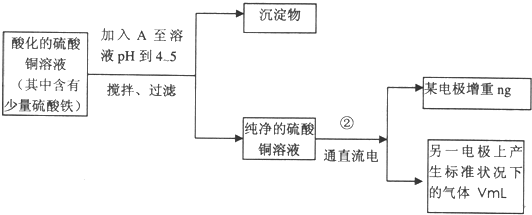
(1)符合条件的A可能是
a.NH3?H2O b.Cu c.CuO d.Cu(OH)2
(2)过滤操作中用到的玻璃仪器有
(3)电解开始一段时间后,在U形管中观察到的现象有
(4)下列实验操作中必要的是(填字母)
A.称量电解前电极的质量
B.电解后,电极在烘干称重前,必须用蒸馏水冲洗
C.刮下电解后电极上析出的铜,并清洗、称重
D.电极在烘干称重的操作中必须按“烘干-称重-再烘干-再称重”进行
E.在有空气存在的情况下,烘干电极必须采用低温烘干的方法
(5)铜的相对原子质量为
(用带有n、V的计算式表示).
查看习题详情和答案>>

(1)符合条件的A可能是
cd
cd
a.NH3?H2O b.Cu c.CuO d.Cu(OH)2

(2)过滤操作中用到的玻璃仪器有
烧杯、玻璃棒、漏斗
烧杯、玻璃棒、漏斗
;步骤②中所用的部分仪器如图,则A连接直流电源的负
负
极,B电极上发生的电极反应为40H--4e-═02↑+2H20
40H--4e-═02↑+2H20
.(3)电解开始一段时间后,在U形管中观察到的现象有
铜棒变粗,石墨极上有气泡生成,溶液的颜色变浅
铜棒变粗,石墨极上有气泡生成,溶液的颜色变浅
电解的离子方程式为2Cu2++2H20
2Cu+4H++02↑
| ||
2Cu2++2H20
2Cu+4H++02↑
.
| ||
(4)下列实验操作中必要的是(填字母)
ABDE
ABDE
.A.称量电解前电极的质量
B.电解后,电极在烘干称重前,必须用蒸馏水冲洗
C.刮下电解后电极上析出的铜,并清洗、称重
D.电极在烘干称重的操作中必须按“烘干-称重-再烘干-再称重”进行
E.在有空气存在的情况下,烘干电极必须采用低温烘干的方法
(5)铜的相对原子质量为
| 11200n |
| V |
| 11200n |
| V |