网址:http://m.1010jiajiao.com/timu3_id_184787[举报]
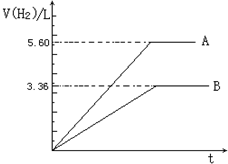 两份质量相等且组成完全相同的镁铝合金,一份投入足量的稀硫酸中,另一份投入足量的氢氧化钠溶液,生成氢气在标准状况下的体积与反应时间的关系如图.
两份质量相等且组成完全相同的镁铝合金,一份投入足量的稀硫酸中,另一份投入足量的氢氧化钠溶液,生成氢气在标准状况下的体积与反应时间的关系如图.计算(要求:计算写明过程):
(1)一份镁铝合金与足量稀硫酸反应时失去电子总物质的量;
(2)合金中镁铝的 物质的量之比;
(3)镁铝合金中镁的质量分数.
 两份质量相等且组成完全相同的镁铝合金,一份投入足量的稀硫酸中,另一份投入足量的氢氧化钠溶液,生成氢气在标准状况下的体积与反应时间的关系如图.
两份质量相等且组成完全相同的镁铝合金,一份投入足量的稀硫酸中,另一份投入足量的氢氧化钠溶液,生成氢气在标准状况下的体积与反应时间的关系如图.
计算(要求:计算写明过程):
(1)一份镁铝合金与足量稀硫酸反应时失去电子总物质的量;
(2)合金中镁铝的 物质的量之比;
(3)镁铝合金中镁的质量分数.
查看习题详情和答案>>
|
下列说法正确的是 | |
A. |
2.3 g钠与97.7 g水反应后溶液中溶质的质量分数等于4% |
B. |
将0.1 mol Na置于足量的氧气中燃烧,该过程转移0.1 mol e- |
C. |
mg不同组成的铝钠合金投入到足量盐酸中,若放出的氢气越多,则钠的质量分数越大 |
D. |
等物质的量的钠、镁、铝与一定量的稀硫酸反应,金属钠产生的气体可能最多 |
镁、铝都是较活泼的金属,在一定条件下能与氧、氮等起反应.镁铝合金粉可用作烟火材料.
(a)取此合金粉与足量的稀硫酸反应,在大气压为101325 Pa,温度为25℃时,在水面上收集到气体的体积为0.5052 L.
(b)另取等量的此合金粉在氧气中燃烧,将燃烧产物用足量的稀硫酸处理,将不溶物用水洗净烘干,称重为0.3399克.
(c)再取等量的此合金粉使之在空气中燃烧,将燃烧产物用足量的稀氢氧化钠溶液处理,将溶液滤去,残渣先用氢氧化钠溶液洗涤,然后用水洗净,再将残渣在高温下灼烧至恒重,得0.7090克.(25℃时,饱和水蒸气压为3167 Pa,R=8.314 kPa·L·mol-1·K-1).
(1)求产生H2的物质的量;
(2)求在氧气中燃烧时生成MgO的质量;
(3)写出(c)中的各步化学反应方程式;
(4)求在空气中燃烧时生成Al2O3的质量;
(5)求合金粉中Al的百分含量.
钠、镁、铝是重要的金属元素,与我们的生活和生产关系密切。
(1)元素的性质特别是化学性质取决于元素原子结构。钠离子的电子排布式为_______,铝元素的原子结构示意图为_________。
(2)钠、镁、铝元素的阳离子半径由小到大的顺序是_____________(用离子符号表示)。在短周期中非金属性最强的元素位于第____周期____族。
(3)钠、镁、铝的单质及其化合物在某些性质上存在着递变规律。下列有关说法正确的是___________(选填编号)。
a.三种元素的金属性越强,金属单质的熔点就越高
b.其碱性按NaOH、Mg(OH)2、Al(OH)3顺序依次减弱
c.常温下都能与浓硝酸剧烈反应生成硝酸盐,但剧烈程度依次减弱
d.等质量的钠、镁、铝与足量稀硫酸反应生成氢气的物质的量依次增加![]()
(4)1932年,美国化学大师Linus Pauling提出电负性(用希腊字母χ表示)的概念,用来确定化合物中原子某种能力的相对大小。Linus Pauling假定氟元素的电负性为4,并通过热化学方法建立了其他元素的电负性。第三周期主族元素的电负性如下:
| 元素 | Na | Mg | Al | Si | P | S | Cl |
| 电负性 | 0.9 | 1.2 | 1.5 | 1.8 | 2.1 | 2.5 | 3.0 |
从上表可以看出电负性的大小与元素非金属性的强弱关系是____________________;大量事实表明,当两种元素的χ值相差大于或等于1.7时,形成的化合物一般是离子化合物,根据此经验规律,AlBr3中的化学键类型应该是 。
查看习题详情和答案>>