摘要:19.Cl2+2Br-=====Br2+2Cl- (2)SO2+Br2+2H2O=====2HBr+H2SO4 (4)BaCl2.NaOH.AgNO3或NaOH.BaCl2.AgNO3 △ 20.(10分.每空2分.只要符合题意即可) 高温 (1)CO+CuO====CO2+Cu 点燃 (2)2Al+Fe2O3====2Fe+Al2O3 △ (3)2Mg+CO2======2MgO+C (4)H2+CuO====H2O+Cu 高温 (5)2C+SiO2=====Si+2CO
网址:http://m.1010jiajiao.com/timu3_id_184569[举报]
 (2013?淄博二模)海水是丰富的资源宝库,从海水中提取元素是化学工业的重要组成部分.
(2013?淄博二模)海水是丰富的资源宝库,从海水中提取元素是化学工业的重要组成部分.(1)粗盐精制就是除去其中的Ca2+、Fe3+、SO42-及泥沙等杂质,需加入的试剂有:
①Na2CO3溶液
②HCl(盐酸)
③Ba(OH)2溶液,这三种试剂的添加顺序是
③①②
③①②
(填序号).(2)用氯气进行“海水提溴”中制取溴单质反应的离子方程式为:
Cl2+2Br-=2Cl-+Br2
Cl2+2Br-=2Cl-+Br2
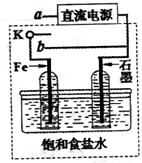
.(3)某同学设计了如图装置进行以下电化学实验.
①当开关K与a连接时,两极均有气泡产生,则阴极为
Fe(或铁)
Fe(或铁)
极.②一段时间后,使开关K与a断开、与b连接时,虚线框内的装置可称为
原电池
原电池
.请写出此时Fe电极上的电极反应式Fe-2e-+2OH-=Fe(OH)2↓
Fe-2e-+2OH-=Fe(OH)2↓
.(4)某公厂向盛有CaSO4悬浊液的反应池中通入氨气欲制取氮肥(NH4)2SO4,效果不好.再通入CO2,则逐渐产生大量(NH4)2SO4.请分析其原因[已知常温下:Ksp(CaSO4)=3.2×10-5,Ksp(CaCO3)=2.8×10-9].
某化学研究性学习小组在实验室中模拟海水提取溴的过程,其实验流程如下:
海水
Br2(g)

Br2
(1)取24L除去悬浮杂质后的海水,浓缩至2L;
(2)向其中通入足量Cl2,反应的离子方程式:
(3)将吹出的Br2用纯碱溶液吸收,反应得到NaBr、NaBrO3和CO2,反应的化学方程式:
(4)将吸收Br2的溶液用足量硫酸处理得到Br2单质,反应的化学方程式:
(5)请计算海水中溴的浓度为
查看习题详情和答案>>
海水
| 除去悬浮 |
| 杂质 |
| 浓缩 |
| 氯化剂 |
| 氯化 |
| 热空气 |
| Na2CO3溶液 |
| 吸收 |

| H2SO4 |
(1)取24L除去悬浮杂质后的海水,浓缩至2L;
(2)向其中通入足量Cl2,反应的离子方程式:
Cl2+2Br-═Br2+2Cl-
Cl2+2Br-═Br2+2Cl-
,通入热空气的目的:将Br2吹出
将Br2吹出
;(3)将吹出的Br2用纯碱溶液吸收,反应得到NaBr、NaBrO3和CO2,反应的化学方程式:
3Br2+3Na2CO3═5NaBr+NaBrO3+3CO2↑
3Br2+3Na2CO3═5NaBr+NaBrO3+3CO2↑
,产生的CO2通入足量澄清石灰水中,得到1g白色沉淀;(4)将吸收Br2的溶液用足量硫酸处理得到Br2单质,反应的化学方程式:
5NaBr+NaBrO3+3H2SO4═3Br2+3Na2SO4+3H2O
5NaBr+NaBrO3+3H2SO4═3Br2+3Na2SO4+3H2O
,理论上可以得到Br2的质量为1.6g
1.6g
;(5)请计算海水中溴的浓度为
0.067
0.067
g/L.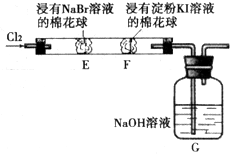 某化学小组用如图所示装置验证卤素单质氧化性的相对强弱.下列说法不正确的是( )
某化学小组用如图所示装置验证卤素单质氧化性的相对强弱.下列说法不正确的是( )