网址:http://m.1010jiajiao.com/timu3_id_184567[举报]
(每空1分,共6分)科学家们在探索生命奥秘的过程中,认识到生命细胞的组成和元素周期律有着密切的联系,约占人体总质量99.97%的11种大量元素全部是元素周期表前20号元素,其余0.03%是由10多种人体不可缺少的微量元素组成。现有a~h 8种短周期元素,是除氧、钾、钙外的其他大量元素,它们在元素周期表中的位置如下,请据此回答下列问题: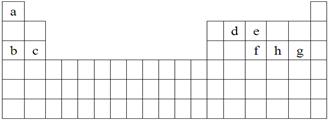
(1)下列中的元素的原子间反应最容易形成离子键的是 。
A.c和f B.b和g C.d和g D.b和e
(2)下列由a~g形成的各分子中所有原子都满足最外层为8电子结构的有 。
A.ea3 B.ag C.fg3 D.dg4
(3)由a、e组成的一种化合物化学式为ea5,其各原子均达到同周期稀有气体原子的稳定结构,试写出该化合物的电子式 ,该物质属于 (填“离子”或“共价”)化合物。
(4)均由a、b、h和氧四种元素形成的两种离子化合物,相互反应可生成有刺激性气味的气体。这两种化合物中有一种相对分子质量为120,该化合物熔化时破坏的是 (填化学键类型,下同),溶于水时破坏的是 。
(每空1分,共6分)科学家们在探索生命奥秘的过程中,认识到生命细胞的组成和元素周期律有着密切的联系,约占人体总质量99.97%的11种大量元素全部是元素周期表前20号元素,其余0.03%是由10多种人体不可缺少的微量元素组成。现有a~h 8种短周期元素,是除氧、钾、钙外的其他大量元素,它们在元素周期表中的位置如下,请据此回答下列问题:

(1)下列中的元素的原子间反应最容易形成离子键的是 。
A.c和f B.b和g C.d和g D.b和e
(2)下列由a~g形成的各分子中所有原子都满足最外层为8电子结构的有 。
A.ea3 B.ag C.fg3 D.dg4
(3)由a、e组成的一种化合物化学式为ea5,其各原子均达到同周期稀有气体原子的稳定结构,试写出该化合物的电子式 ,该物质属于 (填“离子”或“共价”)化合物。
(4)均由a、b、h和氧四种元素形成的两种离子化合物,相互反应可生成有刺激性气味的气体。这两种化合物中有一种相对分子质量为120,该化合物熔化时破坏的是 (填化学键类型,下同),溶于水时破坏的是 。
查看习题详情和答案>>

(1)下列中的元素的原子间反应最容易形成离子键的是 。
A.c和f B.b和g C.d和g D.b和e
(2)下列由a~g形成的各分子中所有原子都满足最外层为8电子结构的有 。
A.ea3 B.ag C.fg3 D.dg4
(3)由a、e组成的一种化合物化学式为ea5,其各原子均达到同周期稀有气体原子的稳定结构,试写出该化合物的电子式 ,该物质属于 (填“离子”或“共价”)化合物。
(4)均由a、b、h和氧四种元素形成的两种离子化合物,相互反应可生成有刺激性气味的气体。这两种化合物中有一种相对分子质量为120,该化合物熔化时破坏的是 (填化学键类型,下同),溶于水时破坏的是 。
(1)工业上生产硫酸时,利用催化氧化反应将SO2转化为SO3是一个关键步骤.压强及温度对SO2转化率的影响如下表(原料气各成分的体积分数为:SO2 7%,O2 11%,N282%):
|
压强/MPa SO2转化率 温度/℃ |
0.1 |
0.5 |
1 |
10 |
| 400 | 99.2% | 99.6% | 99.7% | 99.9% |
| 500 | 93.5% | 96.9% | 97.8% | 99.3% |
| 600 | 73.7% | 85.8% | 89.5% | 96.4% |
②选择适应的催化剂,是否可以提高SO2的转化率?
③已知:2SO2(g)+O2(g)
| ||
| △ |
(2)某地区已探明蕴藏有丰富的赤铁矿(主要成分为Fe2O3,还含有SiO2等杂质)、煤矿、石灰石和黏土,拟在该地区建设大型炼铁厂.
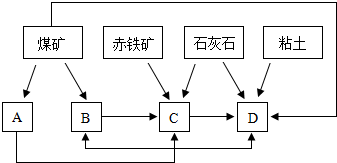
①随着铁矿的开发和炼铁厂的建立,需要在该地区相应建立焦化厂、发电厂、水泥厂等,形成规模的工业体系.据此确定上图中相应工厂的名称B
②以赤铁矿为原料,写出高炉炼铁中得到生铁以及产生炉渣的化学方程式
| ||
| ||
| ||
| ||
③从“三废”利用、环境保护等角度考虑,该地区和企业在生产中应采取的一些措施有(举出1种措施即可)
(10分,每空2分)已知Cr(OH)3在碱性较强的溶液中将生成[Cr(OH)4]―,铬的化合物有毒,由于+6价铬的强氧化性,其毒性是+3价铬毒性的100倍。因此,必须对含铬的废水进行处理,可采用以下两种方法。
还原法在酸性介质中用FeSO4等将+6价铬还原成+3价铬。
具体流程如下:
有关离子完全沉淀的pH如下表: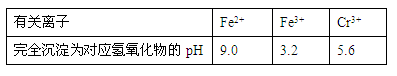
(1)写出Cr2O72—与FeSO4溶液在酸性条件下反应的离子方程式________________________________________________________。
(2)在含铬废水中加入FeSO4,再调节pH,使Fe3+和Cr3+产生氢氧化物沉淀。
则在操作②中可用于调节溶液pH的试剂为:_____________(填序号);
A.Na2O2 B.Ca(OH)2 C.Ba(OH)2 D.NaOH
此时调节溶液的pH范围在____________(填序号)最佳。
A.12~14 B.10~11 C.6~8 D.3~4
(3)将等体积的4.0×10-3mol·L-1的AgNO3和4.0×10-3mol·L-1的K2CrO4溶液混合能析出Ag2CrO4沉淀(Ksp(Ag2CrO4)=9.0×10-12),请写出表示Ag2CrO4溶解平衡的方程式(2分),并简要写出能生成Ag2CrO4沉淀原因的计算过程(2分)。