网址:http://m.1010jiajiao.com/timu3_id_184537[举报]
一种氮肥由硝酸铵和硫酸铵混合而成,取2.12 g这种氮肥溶于水,加入足量的烧碱溶液,加热至气体全部放出,生成的氨气为672 mL(标准状况下)。求这种氮肥的含氮百分率。
(要求写出计算步骤)
查看习题详情和答案>>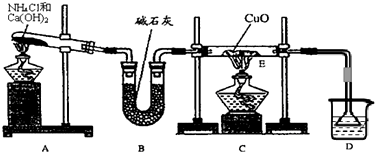
(1)实验室用A图所示实验装置及化学药品(其中碱石灰为固体氢氧化钠和生石灰的混合物来制取氨气.
①实验室制取氨气的化学方程式为
②若用加热碳酸氢铵固体制取纯净的氨气,你认为装置中U型管的作用是
(2)在实验中发现E装置中的固体由黑色变为红色,可推测氨气具有
(3)某同学查阅资料发现Cu2O粉末也呈红色,因此推测上述红色固体中可能还含有Cu2O.已知:①Cu2O是碱性氧化物,在酸性溶液中Cu+不稳定,易转化为Cu和Cu2+.
②在空气中高温灼烧时:Cu2O稳定、不分解,而CuO将分解生成Cu2O和O2.
现有浓硝酸、稀硫酸、稀硝酸、氢氧化钠溶液及pH试纸,而没有其他试剂,请用最简便的实验方法证明红色固体中是否含有Cu2O.(简述操作方法、现象和结论)
(4)现有一份一定质量Cu和Cu2O混合物,向其中加入0.4L 3.0mol/L稀硝酸,混合物完全溶解,同时生成4.48L NO(标准状况),向所得溶液中加入一定体积1.0mol/L NaOH溶液恰好使Cu2+沉淀完全,沉淀经洗涤、充分灼烧可得32.0g固体.下列有关说法正确的是【已知:3Cu2O+14HNO3(稀)═6Cu(NO3)2+2NO↑+7H2O】
A.加入NaOH溶液的体积为1.2L
B.Cu和Cu2O混合物质量为27.2g
C.混合物完全溶解后溶液中n(H+)=0.3mol
D.将等质量混合物完全还原至少需标准状况下H21.12L. 查看习题详情和答案>>

(1)实验室用A图所示实验装置及化学药品(其中碱石灰为固体氢氧化钠和生石灰的混合物来制取氨气.
①实验室制取氨气的化学方程式为
②若用加热碳酸氢铵固体制取纯净的氨气,你认为装置中U型管的作用是
(2)在实验中发现E装置中的固体由黑色变为红色,可推测氨气具有
(3)某同学查阅资料发现Cu2O粉末也呈红色,因此推测上述红色固体中可能还含有Cu2O.已知①Cu2O是碱性氧化物,在酸性溶液中Cu+不稳定,易转化为Cu和Cu2+:Cu+
| H+ |
现有浓硝酸、稀硫酸、稀硝酸、氢氧化钠溶液及pH试纸,而没有其他试剂,请用最简便的实验方法证明红色固体中是否含有Cu2O.
(4)现取该红色固体13.6g在空气中高温灼烧至恒重,发现质量增加了0.8g,试判断该红色固体的组成并求出物质的量.(写出计算过程) 查看习题详情和答案>>
氨是一种重要的化工产品,是氮肥工业及制造硝酸的原料。为探究氨气的性质,某研究性学习小组做了以下实验:

⑴ 实验室用A图所示实验装置及化学药品(其中碱石灰为固体氢氧化钠和生石灰的混合物来制取氨气。
① 实验室制取氨气的化学方程式为 。
② 若用加热碳酸氢铵固体制取纯净的氨气,你认为装置中U型管的作用是
。
⑵ 在实验中发现E装置中的固体由黑色变为红色,可推测氨气具有 性。
⑶ 某同学查阅资料发现Cu2O粉末也呈红色,因此推测上述红色固体中可能还含有Cu2O。已知:① Cu2O是碱性氧化物,在酸性溶液中Cu+不稳定,易转化为Cu和Cu2+。
② 在空气中高温灼烧时:Cu2O稳定、不分解,而CuO将分解生成Cu2O和O2。
现有浓硝酸、稀硫酸、稀硝酸、氢氧化钠溶液及pH试纸,而没有其他试剂,请用最简便的实验方法证明红色固体中是否含有Cu2O。(简述操作方法、现象和结论)
![]() ⑷ 现有一份一定质量Cu和Cu2O混合物,向其中加入0.4L 3.0mol/L稀硝酸,混合物完全溶解,同时生成4.48L NO(标准状况),向所得溶液中加入一定体积1.0mol/L NaOH溶液恰好使Cu2+沉淀完全,沉淀经洗涤、充分灼烧可得32.0g固体。下列有关说法正确的是【已知:3Cu2O + 14HNO3(稀) 6Cu(NO3)2 + 2NO↑+ 7H2O】___________
⑷ 现有一份一定质量Cu和Cu2O混合物,向其中加入0.4L 3.0mol/L稀硝酸,混合物完全溶解,同时生成4.48L NO(标准状况),向所得溶液中加入一定体积1.0mol/L NaOH溶液恰好使Cu2+沉淀完全,沉淀经洗涤、充分灼烧可得32.0g固体。下列有关说法正确的是【已知:3Cu2O + 14HNO3(稀) 6Cu(NO3)2 + 2NO↑+ 7H2O】___________
A.加入NaOH溶液的体积为1.2L
B.Cu和Cu2O混合物质量为27.2g
C.混合物完全溶解后溶液中n(H+)=0.3mol
D.将等质量混合物完全还原至少需标准状况下H21.12L
查看习题详情和答案>>(1)20世纪前,黑火药是世界上唯一的火箭用推进剂,黑火药是由硝酸钾、硫磺、木炭组成,黑火药爆炸的化学方程式为2KNO3+S+3C═K2S+N2↑+3CO2↑.
①写出K2S的电子式:
②某化学兴趣小组进行了如下实验:
实验一:取适量黑火药溶于水,过滤,将滤液蒸发浓缩,冷却后慢慢加入浓硫酸,将混合液置于试管中并放入铜片,产生大量红棕色气体,写出该反应的离子方程式:
实验二:取黑火药爆炸后的残留固体,加水溶解过滤,取滤液向其中滴加新制氯水至过量,一开始溶液变浑浊后又变澄清.请设计实验方案证明该澄清溶液中含有Cl-:
(2)1947年,研制出第二代聚硫橡胶、高氯酸铵、铝粉复合推进剂.高氯酸铵受撞击会引发剧烈爆炸,其爆炸产物有4种,2种产物是空气中的主要成分,另一种气体产物能使湿润的蓝色石蕊试纸变红,写出该反应的化学方程式:
(3)20世纪60年代,美国大推力火箭使用的是液体推进剂,常用的氧化剂有双氧水、四氧化二氮、液氧;可燃物有肼(N2H4)、一甲肼、偏二甲肼、液氢等.火箭发射时将两种液体分别注入火箭发动机的燃烧室中燃烧.偏二甲肼的系统命名为1,1-二甲基联氨,它的结构简式为
(4)以上的火箭推进剂一般都含有氮元素,含氮化合物种类丰富,科学家从化肥厂生产的硫酸铵中检出组成为N4H4(SO4)2的物质,该物质为易溶于水的强电解质,遇烧碱会生成N4气体,该反应的离子方程式: