网址:http://m.1010jiajiao.com/timu3_id_183961[举报]
海洋是资源的宝库,用海水可生产食盐和金属镁或镁的化合物,其操作过程如下图所示:

请回答下列问题:
(1)步骤④反应的离子方程式______。
(2)实验室由粗盐结晶制精盐的操作包括溶解、过滤、蒸发等步骤。
①粗盐提纯过程中过滤的目的是______(填序号)。
A.获得NaCl晶体 B.除去难溶性物质
C.除去易挥发物质 D.除去可溶性物质
②过滤需要用到的玻璃仪器有玻璃棒、______、______。
(3)Mg(OH)2加热分解生成MgO和H2O,MgO是高熔点的化合物。某些材料因含有Mg(OH)2而具有阻燃性。简析Mg(OH)2能够阻燃的原因。
①______;②______。
(4)电解MgCl2制金属Mg的反应方程式为:MgCl2 Mg+Cl2↑。电解0.2mol MgCl2可生成金属Mg的质量为______,同时可得到氯气的体积为______L(标准状况)。
Mg+Cl2↑。电解0.2mol MgCl2可生成金属Mg的质量为______,同时可得到氯气的体积为______L(标准状况)。
查看习题详情和答案>>
(12分)通过火法冶金炼出的铜是粗铜,含杂质金、银、铁、锌,不适合电器及其他仪器使用,必须进行电解精炼。表1为几种物质的溶度积。
表1:几种物质的溶度积
物 质 | Fe(OH)2 | Fe(OH)3 | Zn(OH)2 | Cu(OH)2 |
溶度积Ksp | 8.0×10-16 | 4.0×10-38 | 3×10-17 | 2.2×10-20 |
(1)在精炼铜时,阳极是 (填“纯铜板”或“粗铜板”);金、银失电子能力比铜弱,因此以单质的形式沉积在电解槽 (填“阳极”或“阴极”)的槽底,阴极电极反应方程式是 。
(2)在精炼铜的过程中,Cu2+浓度逐渐减少,c(Fe2+)、c(Zn2+)会逐渐增大,所以需定时除去其中的Fe2+、Zn2+。甲同学设计了除杂方案(见下图)。
①试剂a是 ,加入试剂a的目的是 。
②操作①是 ,根据溶度积,除杂方案中能够除去的杂质金属阳离子是 。
③乙同学在查阅课本时发现,“工业原料氯化铵中含杂质氯化铁,使其溶解于水,再加入氨水调节PH至7~8,可使Fe3+生成Fe(OH)3沉淀而除去。”乙同学认为甲同学的除杂方案中也应该将溶液PH调至7~8。你认为乙同学的建议是否正确?(填“是”或“否”) ,
理由是 。
查看习题详情和答案>>
例如:
①为了除去氯化铵中的杂质Fe3+,先将混合物溶于水,再加入一定量的试剂反应,过滤结晶即可;
②为了除去氯化镁晶体中的杂质Fe3+,先将混合物溶于水,加入足量的氢氧化镁,充分反应,过滤结晶即可;
③为了除去硫酸铜晶体中的杂质Fe2+,先将混合物溶于水,加入一定量的H2O2,将Fe2+氧化成Fe3+,调节溶液的pH=4,过滤结晶即可。
请回答下列问题:
(1)上述三个除杂方案都能够达到很好效果,Fe3+、Fe2+都被转化为________(填化学式)而除去。
(2)①中加入的试剂应该选择________为宜,其原因是___________________________。
(3)②中除去Fe3+所发生的总反应的离子方程式为_______________________________。
(4)下列与方案③相关的叙述中,正确的是________(填字母)。
A.H2O2是绿色氧化剂,在氧化过程中不引进杂质,不产生污染
B.将Fe2+氧化为Fe3+的主要原因是Fe(OH)2沉淀比Fe(OH)3沉淀较难过滤
C.调节溶液pH=4可选择的试剂是氢氧化铜或碱式碳酸铜
D.Cu2+可以大量存在于pH=4的溶液中
E.在pH>4的溶液中Fe3+一定不能大量存在
海洋是资源的宝库,海水中所含食盐高达4×1016t。用海水可生产食盐和金属
镁或镁的化合物,其过程如下图所示。
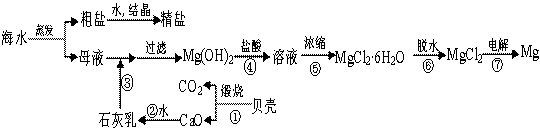 (1)贝壳主要成分的化学式 。
(1)贝壳主要成分的化学式 。
(2)步骤④反应的离子方程式 。
(3)实验室由粗盐结晶制精盐的操作包括溶解、过滤、蒸发等步骤。
A.粗盐提纯过程中过滤的目的是 (填序号)
①获得NaCl晶体 ②除去难溶性物质 ③除去易挥发物质 ④除去可溶性物质
B.过滤需要用到的玻璃仪器有玻璃棒 、 。
(4)Mg(OH)2加热分解生成MgO和H2O,MgO是高熔点的化合物。某些材料因含有Mg(OH)2而具有阻燃性。简析Mg(OH)2能够阻燃的原因。
① ②
(5)电解MgCl2制金属Mg的反应方程式为:MgCl2![]() Mg+Cl2↑。电解0.2molMgCl2可生成金属Mg g,同时可得到氯气 L(标准状况)。
Mg+Cl2↑。电解0.2molMgCl2可生成金属Mg g,同时可得到氯气 L(标准状况)。
| 难容电解质 | Mg(OH)2 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 溶解度/g | 9×10-4 | 1.7×10-6 | 1.5×10-4 | 3.0×10-9 |
在无机化合物的提纯中,常利用难溶电解质的溶解平衡原理除去某些离子。例如:
①为了除去氯化铵中的杂质Fe3+,先将混合物溶于水,加入一定量的试剂反应,过滤后结晶。
②为了除去氯化镁晶体中的杂质Fe3+,先将混合物溶于水,加入足量的Mg(OH)2,充分反应,过滤后结晶。
③为了除去硫酸铜晶体中的杂质Fe2+,先将混合物溶于水,加入一定量的H2O2,将Fe2+氧化成Fe3+,调节溶液的pH=4,过滤后结晶。
请回答下列问题:
(1)上述三种除杂方案都能够达到很好的效果,Fe2+、Fe3+都被转化为 而除去。
(2)①中加入的试剂应该选择 为宜。
(3)②中除去Fe3+所发生的总反应的离子方程式为 。
(4)下列与方案③相关的叙述中,正确的是 (填字母)。
A.H2O2是绿色氧化剂,在氧化过程中不引进杂质、不产生污染
B.将Fe2+氧化为Fe3+的主要原因是Fe(OH)2沉淀比Fe(OH)3沉淀较难过滤
C.调节溶液pH=4可选择的试剂是氢氧化铜或碱式碳酸铜
D.Cu2+可以大量存在于pH=4的溶液中
E.在pH>4的溶液中Fe3+一定不能大量存在