摘要:22.回答下列问题: (1)下列仪器中:①漏斗 ②容量瓶 ③蒸馏烧瓶 ④天平 ⑤分液漏斗 ⑥量筒⑦燃烧匙. 常用于物质分离的是 .其中根据物质沸点不同来分离物质的仪器 是 . (2)今欲用NaOH固体配制500mL 0.2mol/L的NaOH溶液.根据题意填空: A.配制该溶液应选用 mL容量瓶. B.用托盘天平称取 g固体NaOH. C.将称好的NaOH固体放至500mL的大烧杯中.倒入约250mL蒸馏水.用 搅拌至完全溶解.待冷却至室温后.将烧杯中的溶液用玻璃棒引流转移至容量瓶. D.用少量蒸馏水洗涤烧杯2-3次.并将每次洗涤的溶液都注入容量瓶. 轻轻晃动容量瓶.使溶液混和均匀. E.向容量瓶中加入蒸馏水.直到液面离刻度线约1-2厘米时.改用 滴加蒸馏水至液面与刻度线相切.盖好瓶塞.摇匀.如果加水时液面超过刻度线.将使配得的溶液浓度 (填“偏高 .“偏低 或 “无影响 ). F.配制好的溶液 长期存放在容量瓶中. 高温 23.工业上常通过高温分解FeSO4的方法制备Fe2O3.其化学方程式为: 2FeSO4 ==== Fe2O3 +SO2↑+SO3↑ 为检验FeSO4高温分解的产物.进行如下实验: ①取少量FeSO4高温分解得到的固体.加一定量稀盐酸溶解.向该溶液中加入适量的KSCN溶液.观察溶液颜色的变化以检验Fe3+是否存在. ②将FeSO4高温分解产生的气体通入右图所示的装置中.以检验产生的气体中是否含有SO2和SO3.请回答以下问题: (1)写出用KSCN检验Fe3+的离子方程式 . (2)操作②中氯化钡溶液中的现象是 .品红溶液的作用是 .品红溶液中可观察到现象是 . (3)操作②中最后要将通过品红溶液的气体再通入NaOH溶液中.这样做的目的是 .氢氧化钠溶液中发生反应的化学方程式为 .
网址:http://m.1010jiajiao.com/timu3_id_182598[举报]
回答下列问题:
(1)下列仪器中:①漏斗②容量瓶③蒸馏烧瓶④天平⑤分液漏斗⑥滴定管⑦燃烧匙,常用于物质分离的是______(填编号).
(2)实验室里化学试剂的保存方法是不相同的,图中A、B、C、D是常见的一些保存药品的试剂瓶.请把下列常见试剂的序号填写在应要保存的各试剂瓶下面的括号内:①浓硫酸 ②碳酸钠溶液 ③大理石 ④酒精 ⑤氯水 ⑥浓硝酸
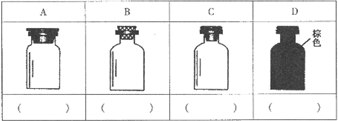
查看习题详情和答案>>
回答下列问题:
(1)下列仪器中:①漏斗②容量瓶③蒸馏烧瓶④天平⑤分液漏斗⑥滴定管⑦燃烧匙,常用于物质分离的是______(填编号).
(2)实验室里化学试剂的保存方法是不相同的,图中A、B、C、D是常见的一些保存药品的试剂瓶.请把下列常见试剂的序号填写在应要保存的各试剂瓶下面的括号内:①浓硫酸 ②碳酸钠溶液 ③大理石 ④酒精 ⑤氯水 ⑥浓硝酸
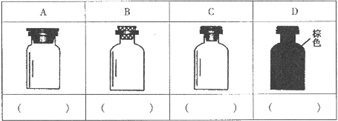
查看习题详情和答案>>
(1)下列仪器中:①漏斗②容量瓶③蒸馏烧瓶④天平⑤分液漏斗⑥滴定管⑦燃烧匙,常用于物质分离的是______(填编号).
(2)实验室里化学试剂的保存方法是不相同的,图中A、B、C、D是常见的一些保存药品的试剂瓶.请把下列常见试剂的序号填写在应要保存的各试剂瓶下面的括号内:①浓硫酸 ②碳酸钠溶液 ③大理石 ④酒精 ⑤氯水 ⑥浓硝酸

回答下列问题:
(1)下列仪器中:①漏斗②容量瓶③蒸馏烧瓶④天平⑤分液漏斗⑥滴定管⑦燃烧匙,常用于物质分离的是______(填编号).
(2)实验室里化学试剂的保存方法是不相同的,图中A、B、C、D是常见的一些保存药品的试剂瓶.请把下列常见试剂的序号填写在应要保存的各试剂瓶下面的括号内:①浓硫酸 ②碳酸钠溶液 ③大理石 ④酒精 ⑤氯水 ⑥浓硝酸
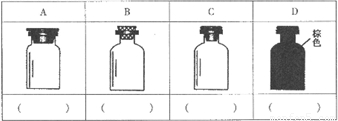
查看习题详情和答案>>
(1)下列仪器中:①漏斗②容量瓶③蒸馏烧瓶④天平⑤分液漏斗⑥滴定管⑦燃烧匙,常用于物质分离的是______(填编号).
(2)实验室里化学试剂的保存方法是不相同的,图中A、B、C、D是常见的一些保存药品的试剂瓶.请把下列常见试剂的序号填写在应要保存的各试剂瓶下面的括号内:①浓硫酸 ②碳酸钠溶液 ③大理石 ④酒精 ⑤氯水 ⑥浓硝酸

查看习题详情和答案>>
回答下列问题(填序号):
(1)下列仪器中:①漏斗;②容量瓶;③蒸馏烧瓶;④天平;⑤分液漏斗;⑥量筒;⑦燃烧匙.常用于物质分离的是______,其中根据物质沸点不同来分离物质的仪器是______.(用序号填写)
(2)今欲用NaOH固体配制500mL0.2mol/L的NaOH溶液.根据题意填空:
A.配制该溶液应选用______mL容量瓶.
B.用托盘天平称取______g固体NaOH.
C.将称好的NaOH固体放至500mL的大烧杯中,倒入约250mL蒸馏水,用______搅拌至完全溶解.待冷却至室温后,将烧杯中的溶液用玻璃棒引流转移至容量瓶.
D.用少量蒸馏水洗涤烧杯2-3次,并将每次洗涤的溶液都注入容量瓶,轻轻晃动容量瓶,使溶液混和均匀.
E.向容量瓶中加入蒸馏水,直到液面离刻度线约1-2厘米时,改用______滴加蒸馏水至液面与刻度线相切.盖好瓶塞,摇匀.如果加水时液面超过刻度线,将使配得的溶液浓度______(填“偏高”、“偏低”或“无影响”).
F.配制好的溶液______(填“能”或“不能”)长期存放在容量瓶中.
查看习题详情和答案>>
(1)下列仪器中:①漏斗;②容量瓶;③蒸馏烧瓶;④天平;⑤分液漏斗;⑥量筒;⑦燃烧匙.常用于物质分离的是______,其中根据物质沸点不同来分离物质的仪器是______.(用序号填写)
(2)今欲用NaOH固体配制500mL0.2mol/L的NaOH溶液.根据题意填空:
A.配制该溶液应选用______mL容量瓶.
B.用托盘天平称取______g固体NaOH.
C.将称好的NaOH固体放至500mL的大烧杯中,倒入约250mL蒸馏水,用______搅拌至完全溶解.待冷却至室温后,将烧杯中的溶液用玻璃棒引流转移至容量瓶.
D.用少量蒸馏水洗涤烧杯2-3次,并将每次洗涤的溶液都注入容量瓶,轻轻晃动容量瓶,使溶液混和均匀.
E.向容量瓶中加入蒸馏水,直到液面离刻度线约1-2厘米时,改用______滴加蒸馏水至液面与刻度线相切.盖好瓶塞,摇匀.如果加水时液面超过刻度线,将使配得的溶液浓度______(填“偏高”、“偏低”或“无影响”).
F.配制好的溶液______(填“能”或“不能”)长期存放在容量瓶中.

