网址:http://m.1010jiajiao.com/timu3_id_181622[举报]
从2011年3月16日下午开始,大陆“海水受日本核辐射污染,碘可防辐射”等消息疯传,从浙江沿海地区开始出现抢盐潮,接着蔓延到多个城市,人们抢购加碘盐是因为食盐中添加了碘元素.
I.人们在即将受到核辐射前的24小时内,需在医生指导下服用碘片,成人推荐服用量为100mg碘,假设此碘盐碘元素含量为50mg/kg,要达到上述碘含量要求,需服用该碘盐______kg,你觉得服用碘盐防辐射合理吗?______
II.图1为某加碘盐标签的一部分.
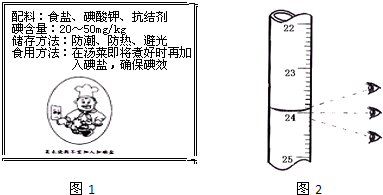
已知:①KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O
②I2+2Na2S2O3=2NaI+Na2S4O6(无色)
某同学欲测定此加碘盐中碘元素的含量,进行以下实验:
步骤1:称取ag市售食盐,配成溶液,全部转移至锥形瓶中,加入适量新制KI溶液,滴入几滴稀硫酸,溶液变黄色,再加入3滴淀粉溶液.
步骤2:取一支50.00mL碱式滴定管,用bmol?L-1的新制Na2S2O3溶液润洗2~3次后,装满溶液,调节液面高度至0刻度.
步骤3:开始滴定直至终点,重复操作2~3次,实验数据记录如下:
| 编号 | 碱式滴定管读数 | 消耗体积(mL) | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 0 | 如图2 | |
| 2 | 0 | 23.97 | 23.97 |
| 3 | 0 | 24.03 | 24.03 |
(2)滴定终点的判断方法______.
(3)经过计算,此加碘盐碘元素的含量为______mg/kg(用包含a、b的最简表达式表示).
(4)下列操作可能会导致测量结果偏高的是______.
A.步骤1中称取食盐时将砝码放在左盘,食盐放在放在右盘,游码读数为0.5g
B.步骤1所配食盐溶液未完全转移至锥形瓶
C.步骤2中滴定管洗涤后未润洗
D.步骤3滴定前滴定管尖嘴处有气泡,滴定后气泡消失. 查看习题详情和答案>>
铁、铝、铜等金属及其化合物在日常生活中应用广泛,请根据下列实验回答问题:
(1)生铁中含有一种铁碳化合物X(Fe3C)。X在足量的空气中高温煅烧,生成有磁性的固体Y,将Y溶于过量盐酸的溶液中含有的大量阳离子是 。
(2)某溶液中有Mg2+、Fe2+、Al3+、Cu2+等四种离子,向其中加入过量的NaOH溶液后,过滤,将滤渣高温灼烧并将灼烧后的固体投入过量的稀盐酸中,所得溶液与原溶液相比,溶液中大量减少的阳离子是 。
A.Mg2+B.Fe2+??????????????????? C.Al3+D.Cu2+
(3)氧化铁是重要工业颜料,用废铁屑制备它的流程如下:

回答下列问题:
①操作Ⅰ的名称是 ,操作Ⅱ的名称是 。
②写出在空气中煅烧FeCO3的化学方程式 。
(4)有些同学认为KMnO4溶液滴定也能进行铁元素含量的测定。
a.称取2.850 g绿矾(FeSO4·7H2O)产品,溶解,在250 mL容量瓶中定容;
b.量取25.00 mL待测溶液放入锥形瓶中;
c.用硫酸酸化的0.010 00 mol·L-1 KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00 mL。
①实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250 mL,配制时需要的仪器除天平、玻璃棒、烧杯、胶头滴管外,还需 。
②某同学设计的下列滴定方式,最合理的是 。(夹持部分略去)(填字母序号)

③写出滴定过程中反应的离子方程式: 。
④计算上述样品中FeSO4·7H2O的质量分数为 。
查看习题详情和答案>>
下列叙述中,不正确的是( )
A.某特定反应的平衡常数仅是温度的函数
B.化学平衡发生移动,平衡常数必发生变化
C.平衡常数发生变化,化学平衡必定发生移动达到新的平衡
D.催化剂不能改变平衡常数的大小
查看习题详情和答案>>
下列叙述正确的是( )
| A.某醋酸溶液的pH=a,将此溶液稀释10倍后,溶液的pH=b,则a=b+1 |
| B.在滴有酚酞溶液的氨水中,加入NH4Cl至溶液恰好无色,则此时溶液的c (NH4+) = c(Cl-) |
| C.25℃0.5×10-3 mol/L硫酸的pH=3.0,升高温度溶液pH增大 |
| D.100℃时,KW= 10-12,若pH=1的盐酸与pH=11NaOH溶液混合后,溶液的pH=7,则盐酸与NaOH溶液体积比为1:1 |


