网址:http://m.1010jiajiao.com/timu3_id_18138[举报]

(1)“低碳生活”倡导低能量、低消耗,主要是为了减少
(2)如图1为元素周期表中的一格,下列说法不正确的是
A.碳元素属于非金属元素
B.碳原子核内质子数为6
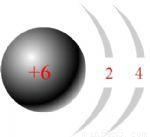
C.碳元素的原子结构示意图为

D.碳的相对原子质量为12.01
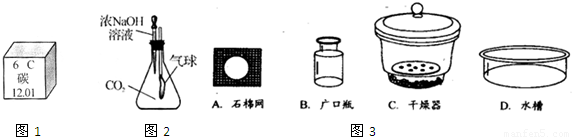
(3)如图2是某趣味实验装置图.挤压胶头滴管后,可观察到气球胀大的现象.请分析其原因,并写出化学方程式.
(4)已知碳酸氢钠在270℃左右就能分解为碳酸钠、水和二氧化碳,而碳酸钠受热不分解.现有某工厂生产出的一批碳酸氢钠中混有少量的碳酸钠,为了测定产品中碳酸氢钠质量分数,具体的检验步骤如下:
①取一只洁净的坩埚,称其质量为ag;再向其中加入样品,称得总质量为m1g;
②加热该盛有样品的坩埚;
③将坩埚充分冷却,称量坩埚和剩余固体的质量;
④多次重复步骤②和③至恒重,称得坩埚和剩余固体的总质量为m2g.
(1)写出碳酸氢钠受热分解的化学方程式
| ||
| ||
(2)用
(3)根据题意,用a、m1、m2的代数式表示样品中碳酸氢钠的质量分数为
| 84(m1-m2) |
| 31(m1-a) |
| 84(m1-m2) |
| 31(m1-a) |
(4)步骤①、③和④都需要用到精度为0.1g的托盘天平称量,若本题中(m1-m2)的值超过0.6g,假设样品中碳酸氢钠的质量分数为90%,则至少需称样品多少克?
碳是形成化合物种类最多的元素,含碳物质是中学化学研究的重要内容.
(1)“低碳生活”倡导低能量、低消耗,主要是为了减少________(填化学式)的排放量.
(2)如图1为元素周期表中的一格,下列说法不正确的是________(填标号).
A.碳元素属于非金属元素
B.碳原子核内质子数为6
C.碳元素的原子结构示意图为
D.碳的相对原子质量为12.01
(3)如图2是某趣味实验装置图.挤压胶头滴管后,可观察到气球胀大的现象.请分析其原因,并写出化学方程式.
(4)已知碳酸氢钠在270℃左右就能分解为碳酸钠、水和二氧化碳,而碳酸钠受热不分解.现有某工厂生产出的一批碳酸氢钠中混有少量的碳酸钠,为了测定产品中碳酸氢钠质量分数,具体的检验步骤如下:
①取一只洁净的坩埚,称其质量为ag;再向其中加入样品,称得总质量为m1g;
②加热该盛有样品的坩埚;
③将坩埚充分冷却,称量坩埚和剩余固体的质量;
④多次重复步骤②和③至恒重,称得坩埚和剩余固体的总质量为m2g.
(1)写出碳酸氢钠受热分解的化学方程式________
(2)用________(填仪器名称,如图3)将加热后的坩埚放到________中(填序号)冷却.
(3)根据题意,用a、m1、m2的代数式表示样品中碳酸氢钠的质量分数为________.
(4)步骤①、③和④都需要用到精度为0.1g的托盘天平称量,若本题中(m1-m2)的值超过0.6g,假设样品中碳酸氢钠的质量分数为90%,则至少需称样品多少克?
查看习题详情和答案>>
(1)“低碳生活”倡导低能量、低消耗,主要是为了减少______(填化学式)的排放量.
(2)如图1为元素周期表中的一格,下列说法不正确的是______(填标号).
A.碳元素属于非金属元素
B.碳原子核内质子数为6
C.碳元素的原子结构示意图为
D.碳的相对原子质量为12.01
(3)如图2是某趣味实验装置图.挤压胶头滴管后,可观察到气球胀大的现象.请分析其原因,并写出化学方程式.
(4)已知碳酸氢钠在270℃左右就能分解为碳酸钠、水和二氧化碳,而碳酸钠受热不分解.现有某工厂生产出的一批碳酸氢钠中混有少量的碳酸钠,为了测定产品中碳酸氢钠质量分数,具体的检验步骤如下:
①取一只洁净的坩埚,称其质量为ag;再向其中加入样品,称得总质量为m1g;
②加热该盛有样品的坩埚;
③将坩埚充分冷却,称量坩埚和剩余固体的质量;
④多次重复步骤②和③至恒重,称得坩埚和剩余固体的总质量为m2g.
(1)写出碳酸氢钠受热分解的化学方程式______ Na2CO3+H2O↑+CO2↑ 查看习题详情和答案>>

(1)“低碳生活”倡导低能量、低消耗,主要是为了减少______(填化学式)的排放量.
(2)如图1为元素周期表中的一格,下列说法不正确的是______(填标号).
A.碳元素属于非金属元素
B.碳原子核内质子数为6
C.碳元素的原子结构示意图为

D.碳的相对原子质量为12.01
(3)如图2是某趣味实验装置图.挤压胶头滴管后,可观察到气球胀大的现象.请分析其原因,并写出化学方程式.
(4)已知碳酸氢钠在270℃左右就能分解为碳酸钠、水和二氧化碳,而碳酸钠受热不分解.现有某工厂生产出的一批碳酸氢钠中混有少量的碳酸钠,为了测定产品中碳酸氢钠质量分数,具体的检验步骤如下:
①取一只洁净的坩埚,称其质量为ag;再向其中加入样品,称得总质量为m1g;
②加热该盛有样品的坩埚;
③将坩埚充分冷却,称量坩埚和剩余固体的质量;
④多次重复步骤②和③至恒重,称得坩埚和剩余固体的总质量为m2g.
(1)写出碳酸氢钠受热分解的化学方程式______ Na2CO3+H2O↑+CO2↑ 查看习题详情和答案>>
碱石灰是氧化钙和氢氧化钠的固体混合物,是实验室常用的干燥剂。相关信息如下图所示。同学们为确认一瓶久置的“碱石灰”(可能已部分变质或全部变质)样品的成分,进行如下探究。

[提出问题]实验室中久置的碱石灰样品的成分是什么?
[进行猜想] 久置的碱石灰样品中可能含有CaO、NaOH、Na2CO3、Ca(OH)2、CaCO3等成分。用化学方程式表示样品中含有Ca(OH)2或Na2CO3可能含有的原因 (写一个)
[探究过程]

试回答下列问题:
(1)操作①的名称是 ,溶液C中一定含 离子。
(2)溶液A中加入CaCl2溶液后产生固体,说明样品中一定含有 ,反应的方程式为 。
(3)向溶液A中加入CaCl2溶液后,证明CaCl2溶液过量的方法是 。
[实验结论]
依据上述实验操作过程及现象,综合对滤液和固体成分的探究,下列对样品成分的分析正确的是 (填序号)
①样品中一定含NaOH ②样品中一定含Na2CO3 ③样品中含NaOH、CaO中的一种或两种
[拓展延伸]
为测定实验室中一瓶变质的烧碱中NaOH的含量,某同学取适量的烧碱样品,溶于一定量的水得到200g溶液;再加入200g稀硫酸(足量)充分搅拌到不再放出气泡为止,称量溶液为395.6g。请分析计算:
(1)反应产生的CO2的质量为 g。
(2)若所取烧碱样品为50.0g,则样品中NaOH的质量分数是多少?(写出计算过程)
(3)用同浓度的硫酸,分别与未变质、部分变质、或全部变质(杂质都是Na2CO3)的烧碱样品反应,需要硫酸的质量都相等。从钠元素质量守恒的角度解释其原因是: 。
【解析】[进行猜想]生成氢氧化钙的方程式为CaO+H2O═Ca(OH)2 生成碳酸钠的方程式为2NaOH+CO2═Na2CO3+H2O
[探究过程]
(1)将固液分离的操作为过滤,酚酞变红了,说明溶液显碱性,故溶液中一定含有OH—
(2)能与氯化钙反应的是碳酸钠,其反应方程式为Na2CO3+CaCl2═2NaCl+CaCO3↓
(3)可以取溶液C于试管中滴加碳酸钠溶液,有白色沉淀生成,则说明CaCl2溶液已过量
[实验结论]因为加水后烧杯壁变热说明样品中含有氢氧化钠或者是氧化钙,或者是二者都有,加入氯化钙生成白色沉淀说明样品中一定含有碳酸钠,综合以上分析,故选②③
[拓展延伸]
(1)根据质量守恒定律可求出反应产生的CO2的质量为200g+200g-395.6g=4.4g
(2)根据二氧化碳的质量为4.4克就可以计算了,根据化学反应方程式计算,即可得出样品中碳酸钠的质量,继而得出原样品中氢氧化钠的质量,具体步骤见答案。
(3)氢氧化钠和碳酸钠都是每46g钠元素生成142g硫酸钠,消耗98g硫酸
查看习题详情和答案>>