摘要:4. C. 46gNa D. 1.204×1024个H2O分子
网址:http://m.1010jiajiao.com/timu3_id_181268[举报]
下表中是各组反应的反应物和反应温度,反应刚开始时,放出H2速率最快的是( )
| 编号 | 金属(粉末状) | 物质量 | 酸浓度 酸体积 |
反应温度 |
| A | Al | 0.1mol | 2mol?L-1 盐酸 10mL |
60℃ |
| B | Fe | 0.1mol | 1mol?L-1 盐酸 10mL |
30℃ |
| C | Mg | 0.1mol | 1mol?L-1 盐酸 10mL |
60℃ |
| D | Mg | 0.1mol | 1mol?L-1 硫酸 10mL |
60℃ |
| A、A | B、B | C、C | D、D |
工业上可以在恒容密闭容器中采用下列反应制备甲醇:CO(g)+2H2(g)?CH3OH(g)
(1)下列情况可以作为判断反应达到平衡状态的依据的是(填序号) .
A.生成CH3OH 的速率与消耗H2的速率之比为1:2
B.混合气体的平均相对分子质量保持不变
C.混合气体的密度保持不变
D.体系内的压强保持不变
(2)下表所列数据为该反应在不同温度下的化学平衡常数:
①该反应的平衡常数表达式为K= .由上表数据判断,该反应的△H 0(填“>”、“=”或“<”).升高温度,正反应速率 (填“增大”、“减小”或“不变”).
②某温度下,将2molCO和6molH2充入一个容积为2L的密闭容器中,达到平衡时c(H2)=1.4mol/L,则CO的转化率为 ,此时的温度为 .
(3)欲提高CO的转化率,可采取的措施是 .(填序号)
A.升温 B.加入更高效的催化剂 C.恒容条件下充入CO
D.恒容条件下充入H2 E.恒容条件下充入氦气 F.及时移走CH3OH
(4)一定条件下,CO和H2在催化剂作用下生成1molCH3OH的能量变化为90.8kJ.该温度下,在三个容积相同的密闭容器中,按不同方式投料,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
下列分析正确的是 .(填序号)
A.2c1<c3 B.2p1<p3 C.|a|+|b|=90.8 D.α1+α3>1.
查看习题详情和答案>>
(1)下列情况可以作为判断反应达到平衡状态的依据的是(填序号)
A.生成CH3OH 的速率与消耗H2的速率之比为1:2
B.混合气体的平均相对分子质量保持不变
C.混合气体的密度保持不变
D.体系内的压强保持不变
(2)下表所列数据为该反应在不同温度下的化学平衡常数:
| 温度/℃、00w | 250 | 300 | 350 |
| K | 2.041 | 0.270 | 0.012 |
②某温度下,将2molCO和6molH2充入一个容积为2L的密闭容器中,达到平衡时c(H2)=1.4mol/L,则CO的转化率为
(3)欲提高CO的转化率,可采取的措施是
A.升温 B.加入更高效的催化剂 C.恒容条件下充入CO
D.恒容条件下充入H2 E.恒容条件下充入氦气 F.及时移走CH3OH
(4)一定条件下,CO和H2在催化剂作用下生成1molCH3OH的能量变化为90.8kJ.该温度下,在三个容积相同的密闭容器中,按不同方式投料,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
| 容器 | 甲 | 乙 | 丙 | |
| 投料方式 | 1molCO、2molH2 | 1molCH3OH | 2molCH3OH | |
| 平衡数据 | C(CH3OH)/(mol/L) | c1 | c2 | c3 |
| 体系压强(Pa) | p1 | p2 | p3 | |
| 反应的能量变化 | akJ | bkJ | ckJ | |
| 原料转化率 | α1 | α2 | α3 | |
A.2c1<c3 B.2p1<p3 C.|a|+|b|=90.8 D.α1+α3>1.
实验:
(1)如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题: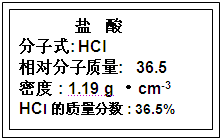
①该浓盐酸中HCl的物质的量浓度为
A.溶液中HCl的物质的量 B.溶液的浓度
C.溶液中Cl-的数目 D溶液的密度
(2)实验室配制480mL0.08mol/LNa2CO3溶液回答下列问题
①应用托盘天平称取十水碳酸钠晶体
②若在称量样品时,药品放在天平右盘上,砝码放在天平左盘上,天平平衡时,则实际称量的碳酸钠晶体是
③用容量瓶配制一定物质的量浓度的溶液,该容量瓶必须是
A、干燥的 B、瓶塞不漏水 C、用欲配制的溶液润洗过 D、以上三项都要求
④若实验遇下列情况,溶液的浓度是“偏高”、“偏低”还是“不变”?
A.加水时越过刻度线
B.忘记将洗涤液加入容量瓶
C.容量瓶内壁附有水珠而未干燥处理
D.溶解后没有冷却便进行定容
(3)①取少量Fe2O3粉末(红棕色)加入适量盐酸,反应的离子方程式为
②取少量溶液置于试管中,滴入NaOH溶液,看到有红褐色沉淀生成,反应的离子方程式为
③在小烧杯中加入25mL蒸馏水,加热至沸腾后,向沸水中加入2mL FeCl3饱和溶液,继续煮沸至溶液呈
④另取一小烧杯加入25mL蒸馏水后,向烧杯中再加入2mL FeCl3饱和溶液,振荡均匀后,将此烧杯(编号甲)与盛有Fe(OH)3胶体的烧杯(编号乙)一起放置暗处,分别用激光笔照射烧杯中的液体,可以看到
查看习题详情和答案>>
(1)如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:

①该浓盐酸中HCl的物质的量浓度为
11.9
11.9
mol?L-1.②取用任意体积的该盐酸溶液时,下列物理量中不随所取体积的多少而变化的是BD
BD
.A.溶液中HCl的物质的量 B.溶液的浓度
C.溶液中Cl-的数目 D溶液的密度
(2)实验室配制480mL0.08mol/LNa2CO3溶液回答下列问题
①应用托盘天平称取十水碳酸钠晶体
11.4
11.4
g②若在称量样品时,药品放在天平右盘上,砝码放在天平左盘上,天平平衡时,则实际称量的碳酸钠晶体是
10.6
10.6
g(1g以下用游码)③用容量瓶配制一定物质的量浓度的溶液,该容量瓶必须是
B
B
A、干燥的 B、瓶塞不漏水 C、用欲配制的溶液润洗过 D、以上三项都要求
④若实验遇下列情况,溶液的浓度是“偏高”、“偏低”还是“不变”?
A.加水时越过刻度线
偏低
偏低
;B.忘记将洗涤液加入容量瓶
偏低
偏低
;C.容量瓶内壁附有水珠而未干燥处理
不变
不变
;D.溶解后没有冷却便进行定容
偏高
偏高
.(3)①取少量Fe2O3粉末(红棕色)加入适量盐酸,反应的离子方程式为
Fe2O3+6H+=2Fe3++3H2O
Fe2O3+6H+=2Fe3++3H2O
,反应后得到黄色的FeCl3溶液.用此溶液做以下实验:②取少量溶液置于试管中,滴入NaOH溶液,看到有红褐色沉淀生成,反应的离子方程式为
Fe3++3O H-=Fe(OH)3↓
Fe3++3O H-=Fe(OH)3↓
.③在小烧杯中加入25mL蒸馏水,加热至沸腾后,向沸水中加入2mL FeCl3饱和溶液,继续煮沸至溶液呈
红褐
红褐
色,即可制得Fe(OH)3胶体.④另取一小烧杯加入25mL蒸馏水后,向烧杯中再加入2mL FeCl3饱和溶液,振荡均匀后,将此烧杯(编号甲)与盛有Fe(OH)3胶体的烧杯(编号乙)一起放置暗处,分别用激光笔照射烧杯中的液体,可以看到
乙
乙
(填甲或乙)烧杯中会产生丁达尔效应.此实验可以区别溶液和胶体
溶液和胶体
.