摘要: 用“双线桥 表示下面氧化还原反应中电子转移的方向和总数.并填空: 4Zn + 10HNO3(稀) = 4Zn(NO3)2 + NH4NO3 + 3H2O 该反应中还原产物是 .被还原和未被还原硝酸的质量比是 .还原产物和氧化产物物质的量之比是 .
网址:http://m.1010jiajiao.com/timu3_id_181215[举报]
用“双线桥”表示下面氧化还原反应中电子转移的方向和总数,并填空:
4Zn+10HNO3(稀)=4Zn(NO3)2+NH4NO3+3H2O
 ,该反应中还原产物是
,该反应中还原产物是
查看习题详情和答案>>
4Zn+10HNO3(稀)=4Zn(NO3)2+NH4NO3+3H2O


NH4NO3
NH4NO3
,被还原和未被还原硝酸的质量比是1:9
1:9
,还原产物和氧化产物物质的量之比是1:4
1:4
,当反应中有4mol电子发生转移时,生成NH4NO3的物质的量是0.5
0.5
mol.分析下面氧化还原反应中化合价变化关系,用双线桥标出电子转移方向和数目,并在横线上回答指定问题。
(1) 2KMnO4+16HCl=2KCl+2MnCl2+5Cl2+8H2O (双线桥法表示2分)
氧化剂 ,还原剂 ,该反应中盐酸既表现 性,又表现 性。
(2)(2分)当有2. 5mol Cl2生成时,转移 mol电子
查看习题详情和答案>>根据下面方程式完成填空:KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O
(1)用双线桥表示电子转移的方向和数目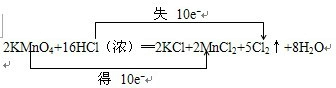

(2)该反应中的
(3)该反应中,氧化剂与还原剂物质的量的比为
(4)反应中若有71克Cl2生成,则被氧化的HCl质量为
(5)如反应转移了0.3mol 电子,则产生的气体在标准状况下的体积为
查看习题详情和答案>>
(1)用双线桥表示电子转移的方向和数目


(2)该反应中的
氯
氯
元素被氧化,高锰酸钾
高锰酸钾
是氧化剂,氯气
氯气
是氧化产物,盐酸
盐酸
发生氧化反应.(3)该反应中,氧化剂与还原剂物质的量的比为
1:10
1:10
.(4)反应中若有71克Cl2生成,则被氧化的HCl质量为
73克
73克
.(5)如反应转移了0.3mol 电子,则产生的气体在标准状况下的体积为
3.36L
3.36L
.
| |||||||||||
 +6I—+6H+=R—+3I2+3H2O,n=_____,R元素在
+6I—+6H+=R—+3I2+3H2O,n=_____,R元素在