网址:http://m.1010jiajiao.com/timu3_id_180852[举报]
| |||||||||||||||||||||||||||
2011年3月,日本福岛核电站发生核泄漏,核泄漏的放射性物质中,大量存在一种叫做“碘-131”的放射性元素。传说吃含碘食品或服碘片可以减缓碘-131对人体的影响,有些人就去抢购碘盐、碘片。下表是某食用碘盐包装袋上的部分说明:
| 配 料 | 食盐、碘酸钾、抗结剂 |
| 碘含量 | 35±15mg/kg |
| 储藏方法 | 密封、避光、防潮 |
| 食用方法 | 烹饪时,待食品熟后加入碘盐 |
| A.碘酸钾可氧化氯化钠 | B.只用淀粉就能检验碘盐中的碘酸钾 |
| C.高温会导致碘的损失 | D.该碘盐中碘酸钾含量约为34~84mg/kg |
 (2)碘酸钾在工业上可用电解法制取。以石墨和不锈钢为电极,以KI溶液为电解液,在一定条件下电解,反应的方程式为:KI + 3H2O KIO3 + 3H2↑。则阳极材料为 。
(2)碘酸钾在工业上可用电解法制取。以石墨和不锈钢为电极,以KI溶液为电解液,在一定条件下电解,反应的方程式为:KI + 3H2O KIO3 + 3H2↑。则阳极材料为 。(3)碘酸钾与碘化钾在酸性条件下发生如下反应,配平化学方程式,并标出电子转移的方向和数目。
KIO3+ KI+ H2SO4
 K2SO4+ I2+ H2O
K2SO4+ I2+ H2O该反应的氧化剂为
(4)已知:I2+2S2O32-→2I-+S4O62-。某学生测定食用碘盐中碘的含量,其步骤为:
a.准确称取w g食盐,加适量蒸馏水使其完全溶解 b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全 c.以淀粉为指示剂,逐滴加入物质的量浓度为2.0×10-3mol·L-1的Na2S2O3溶液10.0mL,恰好反应完全。则所测盐中碘的含量是(以含w的代数式表示) mg/kg。 查看习题详情和答案>>
| 配 料 | 食盐、碘酸钾、抗结剂 |
| 碘含量 | 35±15mg/kg |
| 储藏方法 | 密封、避光、防潮 |
| 食用方法 | 烹饪时,待食品熟后加入碘盐 |
| A.碘酸钾可氧化氯化钠 | B.只用淀粉就能检验碘盐中的碘酸钾 |
| C.高温会导致碘的损失 | D.该碘盐中碘酸钾含量约为34~84mg/kg |
 (2)碘酸钾在工业上可用电解法制取。以石墨和不锈钢为电极,以KI溶液为电解液,在一定条件下电解,反应的方程式为:KI + 3H2O KIO3 + 3H2↑。则阳极材料为 。
(2)碘酸钾在工业上可用电解法制取。以石墨和不锈钢为电极,以KI溶液为电解液,在一定条件下电解,反应的方程式为:KI + 3H2O KIO3 + 3H2↑。则阳极材料为 。(3)碘酸钾与碘化钾在酸性条件下发生如下反应,配平化学方程式,并标出电子转移的方向和数目。
KIO3+ KI+ H2SO4
 K2SO4+ I2+ H2O
K2SO4+ I2+ H2O该反应的氧化剂为
(4)已知:I2+2S2O32-→2I-+S4O62-。某学生测定食用碘盐中碘的含量,其步骤为:
a.准确称取w g食盐,加适量蒸馏水使其完全溶解 b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全 c.以淀粉为指示剂,逐滴加入物质的量浓度为2.0×10-3mol·L-1的Na2S2O3溶液10.0mL,恰好反应完全。则所测盐中碘的含量是(以含w的代数式表示) mg/kg。
Ⅰ)纯净的过氧化钙(CaO2)难溶于水、乙醇,常温下较为稳定。CaO2·8H2O在0℃时稳定,加热至130℃时逐渐变为无水CaO2。在实验室可用钙盐制取CaO2·8H2O,再经脱水制得CaO2。其制备过程如下:
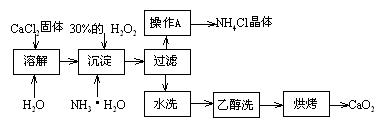
根据以上信息,回答下列问题:
⑴用上述方法制取CaO2·8H2O的化学方程式是_▲_;
⑵测定产品中CaO2的含量的实验步骤是(己知:I2+2S2O32-=2I-+S4O62-):
第一步:准确称取ag产品于锥形瓶中,加入适量蒸馏水和过量的bgKI品体,再滴入适量2mol·L-1的H2SO4溶液,充分反应:
第二步:向上述锥形瓶中加入几滴淀粉溶液:
第三步:逐滴加入浓度为cmol·L-1的Na2S2O3溶液至反应完全,消耗Na2S2O3溶液VmL。
①第三步反应完全时的现象为 ▲ ;
②产品中CaO2的质量分数为 ▲ (用字母表示);
③某同学经实验测得产品中CaO2的质量分数偏高,造成偏高的原因是(测定过程中由操作产生的误差忽略不计,用离子方程式表示) ▲ 。
Ⅱ)硫酸铜是一种重要的化工原料,工业上常用硫酸为原料来制备硫酸铜。
⑴工业上生产硫酸过程中,焙烧硫铁矿时产生的废渣是一种二次资源。
①为了从废渣中磁选获得品位合格的铁精矿,高温下利用CO使弱磁性Fe2O3转化为强磁性Fe3O4。写出该反应的化学方程式_ ▲ _;实验发现:CO太多或太少都会导致磁铁矿产率降低,原因是 ▲ 。
②氯化焙烧工艺是将废渣用氯化钙水溶液调和、成球、高温焙烧,废渣中SiO2与CaCl2等在高温下反应放出HCl,HCl与金属氧化物等反应生成氯化物。反应生成的各金属氯化物以气态形式逸出,进而回收有色金属和回返氯化钙溶液。写出氯化焙烧工艺中生成HCl的化学方程式 ▲ 。
⑵测定硫酸铜品体中结品水含量的实验步骤为:
步骤1:准确称量一个洁净、干燥的坩埚;
步骤2:将一定量的硫酸铜晶体试样研细后,放入坩埚中称重
步骤3:将盛有试样的坩埚加热,待晶体变成白色粉末时,停止加热;
步骤4:将步骤3中的坩埚放入干燥器,冷却至室温后,称重:
步骤5: ▲ ;
步骤6:根据实验数据计算硫酸铜晶体试样中结晶水的质量分数。
请完成实验步骤5。
(3)已知硫酸铜晶体受热可以逐步失去结晶水,温度升高还可以分解生成铜的氧化物。取25.0gCuSO4·5H2O晶体均匀受热,缓慢升温至1200℃并恒温1小时,实验测得固体残留率(剩余固体的质量/原始固体质量)与温度的关系如下图所示:
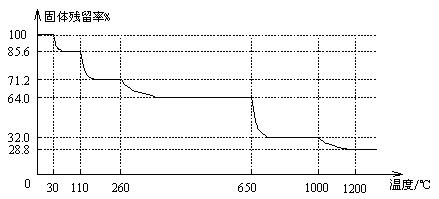
在110℃时所得固体的成分为 ▲ ;在1200℃并恒温1小时,反应所得气态产物除去水后,物质的量为 ▲ 。(填字母)
A.0mol B.0.1mol C.0.125mol D.大于0.125mol
查看习题详情和答案>>Ⅰ)纯净的过氧化钙(CaO2)难溶于水、乙醇,常温下较为稳定。CaO2·8H2O在0℃时稳定,加热至130℃时逐渐变为无水CaO2。在实验室可用钙盐制取CaO2·8H2O,再经脱水制得CaO2。其制备过程如下:
根据以上信息,回答下列问题:
⑴用上述方法制取CaO2·8H2O的化学方程式是_▲_;
⑵测定产品中CaO2的含量的实验步骤是(己知:I2+2S2O32-=2I-+S4O62-):
第一步:准确称取ag产品于锥形瓶中,加入适量蒸馏水和过量的bgKI品体,再滴入适量2mol·L-1的H2SO4溶液,充分反应:
第二步:向上述锥形瓶中加入几滴淀粉溶液:
第三步:逐滴加入浓度为cmol·L-1的Na2S2O3溶液至反应完全,消耗Na2S2O3溶液VmL。
①第三步反应完全时的现象为 ▲ ;
②产品中CaO2的质量分数为 ▲ (用字母表示);
③某同学经实验测得产品中CaO2的质量分数偏高,造成偏高的原因是(测定过程中由操作产生的误差忽略不计,用离子方程式表示) ▲ 。
Ⅱ)硫酸铜是一种重要的化工原料,工业上常用硫酸为原料来制备硫酸铜。
⑴工业上生产硫酸过程中,焙烧硫铁矿时产生的废渣是一种二次资源。
①为了从废渣中磁选获得品位合格的铁精矿,高温下利用CO使弱磁性Fe2O3转化为强磁性Fe3O4。写出该反应的化学方程式_ ▲ _;实验发现:CO太多或太少都会导致磁铁矿产率降低,原因是 ▲ 。
②氯化焙烧工艺是将废渣用氯化钙水溶液调和、成球、高温焙烧,废渣中SiO2与CaCl2等在高温下反应放出HCl,HCl与金属氧化物等反应生成氯化物。反应生成的各金属氯化物以气态形式逸出,进而回收有色金属和回返氯化钙溶液。写出氯化焙烧工艺中生成HCl的化学方程式 ▲ 。
⑵测定硫酸铜品体中结品水含量的实验步骤为:
步骤1:准确称量一个洁净、干燥的坩埚;
步骤2:将一定量的硫酸铜晶体试样研细后,放入坩埚中称重
步骤3:将盛有试样的坩埚加热,待晶体变成白色粉末时,停止加热;
步骤4:将步骤3中的坩埚放入干燥器,冷却至室温后,称重:
步骤5: ▲ ;
步骤6:根据实验数据计算硫酸铜晶体试样中结晶水的质量分数。
请完成实验步骤5。
(3)已知硫酸铜晶体受热可以逐步失去结晶水,温度升高还可以分解生成铜的氧化物。取25.0gCuSO4·5H2O晶体均匀受热,缓慢升温至1200℃并恒温1小时,实验测得固体残留率(剩余固体的质量/原始固体质量)与温度的关系如下图所示:
在110℃时所得固体的成分为 ▲ ;在1200℃并恒温1小时,反应所得气态产物除去水后,物质的量为 ▲ 。(填字母)
A.0mol B.0.1mol C.0.125mol D.大于0.125mol
查看习题详情和答案>>
