网址:http://m.1010jiajiao.com/timu3_id_180763[举报]
(1)制备纯净的硫酸铜称取15g粗CuSO4(含Fe2+)放入小烧杯中,加入50mL蒸馏水,搅拌.滴入少量稀硫酸,再滴加2mL3%的H2O2溶液,充分反应.将溶液冷却,逐滴加入0.5~1mol?L-1的NaOH溶液,直到pH=3.5~4,过滤,滤液转移到洁净的蒸发皿中,用稀硫酸将溶液pH调至1-2,再经蒸发、结晶、洗涤、晾干得精制的硫酸铜晶体(已知开始沉淀至沉淀完全的pH:Fe3+为2~3.7,Cu2+为4.7~6.7).
①加入酸化的过氧化氢溶液,发生反应的离子方程式为
②用NaOH溶液将溶液pH调至3.5~4,其目的是
(2)依据用(1)制得的精制硫酸铜晶体,制备高纯度的Cu(C1O4)2?6H2O,请补充实验
步骤.该实验可选用的试剂有:70%HClO4溶液,Na2CO3?1OH2O,盐酸酸化的氯化钡溶液.
a.称取7.0gCuSO4?5H2O和8.OgNa2CO3?10H2O,混合研细后,投入100mL沸水,快速搅拌,静置得绿色沉淀.
b.过滤,用少量蒸馏水洗涤沉淀
c.用
d.在沉淀中慢慢滴加70%HClO4溶液,搅拌至
e.过滤,得蓝色高氯酸铜溶液.f.在通风橱中蒸发至不再产生白雾,继续蒸发至有晶膜出现,冷却、结晶、过滤、洗涤,得蓝色晶体.
g.60℃下,在烘箱中干燥2h,得Cu(ClO4)2?6H2O晶体8.4g.
①补充上述步骤b、c和d.
②本次实验产率为_
③某温度下,高氯酸铜同时按两种方式分解:(A).Cu(ClO4)2═CuCl2+4O2↑(B).2Cu(ClO4)2═2CuO+7O2↑十+2Cl2↑
若测得V(O2)/V(Cl2)=n,则按(A)式分解的高氯酸铜的质量分数为
| 2n-7 |
| 2n+1 |
| 2n-7 |
| 2n+1 |
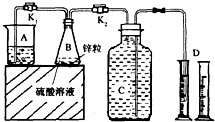 某化学兴趣小组用如图装置进行“市售锌粒和硫酸反应制取氢气的条件选择”的探究:当B中的化学反应趋于平稳后,每间隔一分钟收集一次氢气.不同条件下,每分钟收集到氢气的体积如下表:
某化学兴趣小组用如图装置进行“市售锌粒和硫酸反应制取氢气的条件选择”的探究:当B中的化学反应趋于平稳后,每间隔一分钟收集一次氢气.不同条件下,每分钟收集到氢气的体积如下表:| 实验序号 | 硫酸浓度 | 饱和硫酸铜溶液体积/mL | 反应达到平稳的时间/min | 第1分钟收集氢气体积/mL | 第2分钟收集氢气体积/mL | 第3分钟收集氢气体积/mL | … |
| 1 | 20% | 0 | 5.4 | 6.1 | 11.9 | 13.7 | … |
| 2 | 20% | 0.5 | 2.5 | 23.9 | 32.1 | 33.5 | … |
| 3 | 30% | 0.5 | 1.1 | 60.7 | 89.9 | 90.1 | … |
| 4 | a% | 3.0 | 0.8 | 55.7 | 66.0 | 61.4 | … |
(1)关闭K2、打开K1,观察到
(2)实验l、2是对比探究实验,分析上表,说明该对比探究实验的目的是
(3)细口瓶C的容积为V(mL),为了使加入的锌(质量bg)不浪费,在C中还留有
| 2 |
| 5 |
(4)实验4是研究饱和硫酸铜溶液的体积对实验的影响,a值应为
A. 20 B.30 C.27 D. 40
(5)分析上表,市售锌粒和硫酸反应制取氢气的条件应该选择实验
(6)从实验后的废液中回收皓矾(ZnSO4?7H2O)所需的实验操作步骤是
(7)查资料得知:Cu++Cl-═CuCl↓.
湿法冶锌工艺中,硫酸锌溶液中常含有少量的氯离子,往其中加硫酸铜溶液和金属锌,可除去氯离子,其离子反应方程式是
①最常见的溶剂是
③能产生温室效应的气体是
(2)标准状况下11.2LHCl气体的物质的量是
(3)在V L Al2(SO4)3溶液中,测得含Al3+的质量为a g,则Al2(SO4)3溶液的物质的量浓度为
(4)在标准状况下,2molCO2的体积为
(5)有些膨化食品包装袋中有一个小纸袋,上面写着“干燥剂”,其主要成分是生石灰(CaO).
①生石灰按无机物分类属于
②生石灰可做干燥剂的理由是
③小纸袋中的生石灰能否长期持续地做干燥剂?
醋酸和盐酸是中学化学中常见的酸,在一定条件下,CH3COOH溶液中存在电离平衡:CH3COOH CH3COO-+H+
ΔH>0。
CH3COO-+H+
ΔH>0。
(1)常温下,在 pH =5的稀醋酸溶液中,c(CH3COO-)=____________(列式,不必化简);下列方法中,可以使0.10 mol·L-1 CH3COOH的电离程度增大的是______。
a.加入少量0.10 mol·L-1的稀盐酸 b.加热CH3COOH溶液
c.加水稀释至0.010 mol·L-1 d.加入少量冰醋酸
e.加入少量氯化钠固体 f.加入少量0.10 mol·L-1的NaOH溶液
(2)将等质量的锌投入等体积且pH均等于3的醋酸和盐酸溶液中,经过充分反应后,发现只在一种溶液中有锌粉剩余,则生成氢气的体积:V(盐酸)_________V(醋酸),反应的最初速率为:v(盐酸)_________v(醋酸)。(填写“>”、“<”或“=”)
(3)某同学用0.1000mol/LNaOH溶液分别滴定20.00mL 0.1000mol/LHCl和20.00mL0.1000mol/L CH3COOH,得到如图所示两条滴定曲线,请完成有关问题:

①NaOH溶液滴定CH3COOH溶液的曲线是 (填“图1”或“图2”);
②a= mL。
(4)常温下,将0.1 mol/L盐酸和0.1 mol/L醋酸钠溶液混合,所得溶液为中性,则混合溶液中各离子的浓度按由大到小排序为_______________________________。
(5)已知:90℃时,水的离子积常数为Kw = 3.80×10-13,在此温度下,将pH=3的盐酸和
pH = 11的氢氧化钠溶液等体积混合,则混合溶液中的c(H+)=____________(保留三位有效数字)mol/L。
查看习题详情和答案>>
醋酸和盐酸是中学化学中常见的酸,在一定条件下,CH3COOH溶液中存在电离平衡:CH3COOH CH3COO-+H+ ΔH>0。
CH3COO-+H+ ΔH>0。
(1)常温下,在 pH =5的稀醋酸溶液中,c(CH3COO-)=____________(列式,不必化简);下列方法中,可以使0.10 mol·L-1 CH3COOH的电离程度增大的是______?
a.加入少量0.10 mol·L-1的稀盐酸 b.加热CH3COOH溶液
c.加水稀释至0.010 mol·L-1 d.加入少量冰醋酸
e.加入少量氯化钠固体 f.加入少量0.10 mol·L-1的NaOH溶液
(2)将等质量的锌投入等体积且pH均等于3的醋酸和盐酸溶液中,经过充分反应后,发现只在一种溶液中有锌粉剩余,则生成氢气的体积:V(盐酸)_________V(醋酸),反应的最初速率为:v(盐酸)_________v(醋酸)。(填写“>”、“<”或“=”)
(3)某同学用0.1000mol/LNaOH溶液分别滴定20.00mL 0.1000mol/LHCl和20.00mL0.1000mol/L CH3COOH,得到如图所示两条滴定曲线,请完成有关问题:
①NaOH溶液滴定CH3COOH溶液的曲线是 (填“图1”或“图2”);
②a= mL。
(4)常温下,将0.1 mol/L盐酸和0.1 mol/L醋酸钠溶液混合,所得溶液为中性,则混合溶液中各离子的浓度按由大到小排序为_______________________________。
(5)已知:90℃时,水的离子积常数为Kw = 3.80×10-13,在此温度下,将pH=3的盐酸和
pH = 11的氢氧化钠溶液等体积混合,则混合溶液中的c(H+)=____________(保留三位有效数字)mol/L。