摘要:向40mL1mol·L-1的AlCl3溶液中加入100mLKOH溶液.充分反应得到0.78g沉淀.则KOH溶液的物质的量浓度是多少? 答案:0.3 mol·L-1 1.5mol·L-1
网址:http://m.1010jiajiao.com/timu3_id_177406[举报]
 (2011?佛山一模)纯碱、烧碱等是重要的化工原料.
(2011?佛山一模)纯碱、烧碱等是重要的化工原料.(1)利用如图所示装置可间接证明二氧化碳与烧碱溶液发生了反应:将A与B连接,打开止水夹,将胶头滴管中的液体挤入烧瓶,此时的实验现象是
广口瓶中的水会倒吸入烧瓶
广口瓶中的水会倒吸入烧瓶
,反应的离子方程式是CO2+2OH-=CO32-+H2O
CO2+2OH-=CO32-+H2O
;若其它操作不变,将A与C连接,可观察到的现象是广口瓶中的长导管口有气泡产生
广口瓶中的长导管口有气泡产生
.(2)向100mL2mol/L的NaOH 溶液中通入一定量CO2,充分反应后将溶液蒸发结晶,得到一定量的白色固体.试设计实验确认该白色固体的成分.
①提出合理假设.
假设1:NaOH和Na2CO3;
假设2:只有Na2CO3;
假设3:只有NaHCO3;
假设4:
Na2CO3和NaHCO3
Na2CO3和NaHCO3
.②基于假设1,设计实验方案进行实验证明固体的成分是NaOH和Na2CO3.请在答题卡上写出实验步骤及预期现象和结论.限选实验试剂及仪器:
1moL?L-1HCl溶液、1mol?L-1 MgCl2溶液、0.5moL?L-1BaCl2溶液、1mol?L-1 Ba(OH)2溶液、甲基橙试液、酚酞试液、蒸馏水、试管、过滤装置.(步骤可不填满也可增加)
| 实验步骤 | 预期现象和结论 |
| 步骤1: | 产生白色沉淀,说明固体中含有Na2CO3 产生白色沉淀,说明固体中含有Na2CO3 |
| 步骤2: | 溶液变红色,说明固体中含有NaOH 溶液变红色,说明固体中含有NaOH |
| 步骤3: | 空 空 |
(1)下列电解质中,①NaCl、②NaOH,③NH3?H2O、④CH3COOH,⑤BaSO4、⑥HCl ⑦H2O是强电解质的是
(2)火箭推进器中有燃料肼(N2H4)和液态双氧水,它们反应产生氮气和水蒸气并放出热.已知:0.4mol液态肼与足量的液态双氧水反应生成氮气和水蒸气,放出256.652kJ的热量.该反应的热化学方程式
(3)向1L1mol/L的NaOH溶液中加入下列物质:①浓H2SO4;②稀硝酸;③稀醋酸,恰好完全反应的热效应△H1、△H2、△H3的大小关系为
(4)已知下列反应的反应热为:
①CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l)△H1=-870.3KJ/mol
②C(s)+O2(g)=CO2(g)△H2=-393.5KJ/mol
③2H2(g)+O2(g)=2H2O(l)△H3=-571.6KJ/mol则 2C(s)+2H2(g)+O2(g)=CH3COOH(l)△H=
查看习题详情和答案>>
①②⑤⑥
①②⑤⑥
,是弱电解质的是③④⑦
③④⑦
(2)火箭推进器中有燃料肼(N2H4)和液态双氧水,它们反应产生氮气和水蒸气并放出热.已知:0.4mol液态肼与足量的液态双氧水反应生成氮气和水蒸气,放出256.652kJ的热量.该反应的热化学方程式
N2H4(g)+2H2O2(l)=N2(g)+4H2O(g)△H=-641.63kJ/mol
N2H4(g)+2H2O2(l)=N2(g)+4H2O(g)△H=-641.63kJ/mol
(3)向1L1mol/L的NaOH溶液中加入下列物质:①浓H2SO4;②稀硝酸;③稀醋酸,恰好完全反应的热效应△H1、△H2、△H3的大小关系为
△H3>△H2>△H1
△H3>△H2>△H1
.(4)已知下列反应的反应热为:
①CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l)△H1=-870.3KJ/mol
②C(s)+O2(g)=CO2(g)△H2=-393.5KJ/mol
③2H2(g)+O2(g)=2H2O(l)△H3=-571.6KJ/mol则 2C(s)+2H2(g)+O2(g)=CH3COOH(l)△H=
-488.3kJ/mol
-488.3kJ/mol
.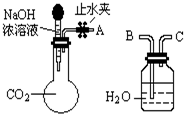 如图装置可证明CO2与NaOH溶液发生了反应:
如图装置可证明CO2与NaOH溶液发生了反应:(1)将A与B连接,打开止水夹将胶头滴管中的液体挤入烧瓶,此时的现象是
(2)向100mL2mol/L的NaOH 溶液中通入一定量CO2,充分反应后,将溶液蒸发结晶,得到少量白色固体,请设计实验确认该固体的成分:
①提出合理假设:
假设1:该固体为NaOH和Na2CO3;
假设2:该固体只有Na2CO3;
假设3:该固体只有
假设4:该固体为
②.请设计实验验证假设1的固体是NaOH和Na2CO3,写出步骤及预期的现象和结论.(步骤可不填满也可增加)
限选的试剂、仪器:1moL?L-1HCl、1mol?L-1 MgCl2、0.5moL?L-1BaCl2和1mol?L-1 Ba(OH)2溶液,甲基橙、酚酞试液,试管、胶头滴管、过滤装置.
| 实验步骤 | 预期现象和结论 |
| 步骤1: |
|
| 步骤2: |
|
| 步骤3: |
现有甲、乙、丙三名同学分别进行Fe(OH)3胶体的制备实验:
甲同学向1mol?L-1氯化铁溶液中加入少量的NaOH溶液;
乙同学直接加热饱和FeCl3溶液;
丙同学向25ml沸水中逐滴加入5~6滴FeCl3饱和溶液;继续煮沸至溶液呈红褐色,停止加热.
试回答下列问题:
(1)其中能得到Fe(OH)3胶体的同学是
(2)证明有Fe(OH)3胶体生成的实验操作是
(3)丁同学利用所制得的Fe(OH)3胶体进行下列实验:
①将其装入U形管内,用石墨作电极,接通直流电,通电一段时间后发现阴极附近的颜色逐渐变深,这表明Fe(OH)3胶粒带
②向其中加入饱和Na2SO4溶液,产生的现象是
(4)Fe(OH)3胶体能稳定存在的主要原因是
查看习题详情和答案>>
甲同学向1mol?L-1氯化铁溶液中加入少量的NaOH溶液;
乙同学直接加热饱和FeCl3溶液;
丙同学向25ml沸水中逐滴加入5~6滴FeCl3饱和溶液;继续煮沸至溶液呈红褐色,停止加热.
试回答下列问题:
(1)其中能得到Fe(OH)3胶体的同学是
丙
丙
.(2)证明有Fe(OH)3胶体生成的实验操作是
使一束光射向烧杯中的液体,若能产生丁达尔效应,则证明生成了氢氧化铁胶体
使一束光射向烧杯中的液体,若能产生丁达尔效应,则证明生成了氢氧化铁胶体
.(3)丁同学利用所制得的Fe(OH)3胶体进行下列实验:
①将其装入U形管内,用石墨作电极,接通直流电,通电一段时间后发现阴极附近的颜色逐渐变深,这表明Fe(OH)3胶粒带
正
正
电荷(填“正”或“负”).②向其中加入饱和Na2SO4溶液,产生的现象是
产生红褐色沉淀
产生红褐色沉淀
.(4)Fe(OH)3胶体能稳定存在的主要原因是
Fe(OH)3胶粒带正电荷,导致胶粒之间互相排斥且胶粒在做布朗运动,所以能稳定存在
Fe(OH)3胶粒带正电荷,导致胶粒之间互相排斥且胶粒在做布朗运动,所以能稳定存在
.