摘要:7.下列外围电子排布式表示的四种元素中.电负性最大的是 A.4s1 B.2s22p5 C.3s23p4 D.3d64s2
网址:http://m.1010jiajiao.com/timu3_id_176113[举报]
下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
| a | | | |||||||||||||||
| | | | | b | c | d | | | |||||||||
| e | | | f | | | | | ||||||||||
| | | | | | | | g | | | | | | | | | | |
(1)用电子式描述a~g中电负性最大和最小的元素形成化合物的过程:
。
(2)c的单质的结构式为: ,已知互为等电子体的分子具有相似的价键结构,写出由上述元素组成与c的单质互为等电子体的电子式(任一种): 。
(3)g元素在周期表中的位置是第四周期, 族,该元素在周期表分区中属于 区;写出g的基态原子的外围电子排布式: 。
(4)分别由a、b、d、f元素形成的单质晶体的熔沸点由高到低顺序为(用单质的化学式表示): 。
(5)写出由a、b、c、d元素组成,原子个数比为5∶1∶1∶3的化合物与足量烧碱溶液反应的离子方程式: 。 查看习题详情和答案>>
下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
请回答下列问题:
(1)用电子式描述a~g中电负性最大和最小的元素形成化合物的过程:
。
(2)c的单质的结构式为: ,已知互为等电子体的分子具有相似的价键结构,写出由上述元素组成与c的单质互为等电子体的电子式(任一种): 。
(3)g元素在周期表中的位置是第四周期, 族,该元素在周期表分区中属于 区;写出g的基态原子的外围电子排布式: 。
(4)分别由a、b、d、f元素形成的单质晶体的熔沸点由高到低顺序为(用单质的化学式表示): 。
(5)写出由a、b、c、d元素组成,原子个数比为5∶1∶1∶3的化合物与足量烧碱溶液反应的离子方程式: 。
| a | | | |||||||||||||||
| | | | | b | c | d | | | |||||||||
| e | | | f | | | | | ||||||||||
| | | | | | | | g | | | | | | | | | | |
(1)用电子式描述a~g中电负性最大和最小的元素形成化合物的过程:
。
(2)c的单质的结构式为: ,已知互为等电子体的分子具有相似的价键结构,写出由上述元素组成与c的单质互为等电子体的电子式(任一种): 。
(3)g元素在周期表中的位置是第四周期, 族,该元素在周期表分区中属于 区;写出g的基态原子的外围电子排布式: 。
(4)分别由a、b、d、f元素形成的单质晶体的熔沸点由高到低顺序为(用单质的化学式表示): 。
(5)写出由a、b、c、d元素组成,原子个数比为5∶1∶1∶3的化合物与足量烧碱溶液反应的离子方程式: 。
(15分)
X、Y、T、Q 四种元素,位于元素周期表前四周期,元素的性质或结构信息见下表。
| 元素 | 性质或结构信息 |
| X | 单质为双原子分子,分子中含有3对共用电子对,常温下单质气体性质稳定,但其原子较活泼。 |
| Y | 二价阳离子的外围电子层排布为3d9 |
| T | 原子核外s轨道电子总数等于p轨道电子总数;人体内含量最多的元素,且其单质是常见的助燃剂。 |
| Q | 第三周期主族元素中原子半径最小。 |
⑴ 写出 X3- 的一种等电子体的化学式 ; X的气态氢化物易液化的原因是: 。
⑵写出T元素基态原子的核外电子排布图 ;
Q元素的原子核外有 种运动状态不同的电子。
⑶元素 X 、T 的电负性相比, 的小(填元素名称);元素 X 的第一电离能与T相比较,T的 (填“大”或“小”)。
⑷甲醛(CH2O)分子中σ 键与π 键的个数之比为 。
⑸Y元素在周期表中位于 区。Y单质晶体的晶胞如右图所示,
该晶胞中实际拥有 个原子,该晶体中Y原子在三维空间里的
堆积方式为 堆积。

⑹在Y的硫酸盐溶液中通入X的气态氢化物至过量,先出现蓝色沉淀,最后溶解形成深蓝色的溶液。此蓝色沉淀溶解的离子方程式为: 。
⑺元素X与Q可形成化合物XQ3,根据价层电子对互斥理论判断XQ3的空间构型为: ,分子中X原子的杂化方式为 杂化。 查看习题详情和答案>>
(15分)
X、Y、T、Q 四种元素,位于元素周期表前四周期,元素的性质或结构信息见下表。
请根据上述信息回答下列问题:
⑴ 写出 X3- 的一种等电子体的化学式 ; X的气态氢化物易液化的原因是: 。
⑵写出T元素基态原子的核外电子排布图 ;
Q元素的原子核外有 种运动状态不同的电子。
⑶元素 X 、T 的电负性相比, 的小(填元素名称);元素 X 的第一电离能与T相比较,T的 (填“大”或“小”)。
⑷甲醛(CH2O)分子中σ 键与π 键的个数之比为 。
⑸Y元素在周期表中位于 区。Y单质晶体的晶胞如右图所示,
该晶胞中实际拥有 个原子,该晶体中Y原子在三维空间里的
堆积方式为 堆积。
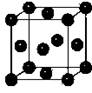
⑹在Y的硫酸盐溶液中通入X的气态氢化物至过量,先出现蓝色沉淀,最后溶解形成深蓝色的溶液。此蓝色沉淀溶解的离子方程式为: 。
⑺元素X与Q可形成化合物XQ3,根据价层电子对互斥理论判断XQ3的空间构型为: ,分子中X原子的杂化方式为 杂化。
X、Y、T、Q 四种元素,位于元素周期表前四周期,元素的性质或结构信息见下表。
| 元素 | 性质或结构信息 |
| X | 单质为双原子分子,分子中含有3对共用电子对,常温下单质气体性质稳定,但其原子较活泼。 |
| Y | 二价阳离子的外围电子层排布为3d9 |
| T | 原子核外s轨道电子总数等于p轨道电子总数;人体内含量最多的元素,且其单质是常见的助燃剂。 |
| Q | 第三周期主族元素中原子半径最小。 |
⑴ 写出 X3- 的一种等电子体的化学式 ; X的气态氢化物易液化的原因是: 。
⑵写出T元素基态原子的核外电子排布图 ;
Q元素的原子核外有 种运动状态不同的电子。
⑶元素 X 、T 的电负性相比, 的小(填元素名称);元素 X 的第一电离能与T相比较,T的 (填“大”或“小”)。
⑷甲醛(CH2O)分子中σ 键与π 键的个数之比为 。
⑸Y元素在周期表中位于 区。Y单质晶体的晶胞如右图所示,
该晶胞中实际拥有 个原子,该晶体中Y原子在三维空间里的
堆积方式为 堆积。

⑹在Y的硫酸盐溶液中通入X的气态氢化物至过量,先出现蓝色沉淀,最后溶解形成深蓝色的溶液。此蓝色沉淀溶解的离子方程式为: 。
⑺元素X与Q可形成化合物XQ3,根据价层电子对互斥理论判断XQ3的空间构型为: ,分子中X原子的杂化方式为 杂化。
 第四周期过渡元素Mn、Fe、Ti可与C、H、O形成多种化合物.
第四周期过渡元素Mn、Fe、Ti可与C、H、O形成多种化合物.(1)下列叙述正确的是
AD
AD
.(填字母)A.CH2O与水分子间能形成氢键
B.CH2O和CO2分子中的中心原子均采用sp2杂化
C.C6H6分子中含有6个?键和1个大π键,C6H6是非极性分子
D.CO2晶体的熔点、沸点都比二氧化硅晶体的低
(2)Mn和Fe的部分电离能数据如下表:
| 元 素 | Mn | Fe | |
| 电离能 /kJ?mol-1 |
I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
3d54s2
3d54s2
,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难,其原因是Mn2+转化为Mn3+时,3d能级由较稳定的3d5半充满状态转变为不稳定的3d4状态,而Fe2+转化为Fe3+时,3d能级由不稳定的3d6状态转变为较稳定的3d5半充满状态.
Mn2+转化为Mn3+时,3d能级由较稳定的3d5半充满状态转变为不稳定的3d4状态,而Fe2+转化为Fe3+时,3d能级由不稳定的3d6状态转变为较稳定的3d5半充满状态.
.(3)根据元素原子的外围电子排布的特征,可将元素周期表分成五个区域,其中Ti属于
d区
d区
区.(4)Ti的一种氧化物X,其晶胞结构如上图所示,则X的化学式为
TiO2
TiO2
.(5)电镀厂排放的废水中常含有剧毒的CN-离子,可在X的催化下,先用NaClO将CN-氧化成CNO-,再在酸性条件下CNO-继续被NaClO氧化成N2和CO2.
①H、C、N、O四种元素的电负性由小到大的顺序为
H<C<N<O
H<C<N<O
.②与CNO-互为等电子体微粒的化学式为
CO2
CO2
(写出一种即可).③氰酸(HOCN)是一种链状分子,它与异氰酸(HNCO)互为同分异构体,其分子内各原子最外层均已达到稳定结构,试写出氰酸的结构式
N≡C-O-H
N≡C-O-H
.