摘要:21.有关反应:2CuO + C 2Cu + CO2↑的说法不正确的是 A.该反应属于置换反应 B.C→CO2属于氧化反应 C.CuO→ Cu属于还原反应 D.碳在反应中得到电子
网址:http://m.1010jiajiao.com/timu3_id_175938[举报]
(1)-COOH的名称是
 ,苯发生硝化反应的化学方程式为
,苯发生硝化反应的化学方程式为 +HNO3
+HNO3
 +H2O
+H2O +HNO3
+HNO3
 +H2O.
+H2O.
(2)相对分子质量为72的烷烃的分子式是
它可能的结构简式是 、
、 、CH3CH2CH2CH2CH3
、CH3CH2CH2CH2CH3 、
、 、CH3CH2CH2CH2CH3.
、CH3CH2CH2CH2CH3.
(3)在焊接铜漆包线时,常先把线头放在火上烧一下,以除去漆层,并立即在酒精中蘸一下才焊接,这是因为(用化学方程式表示):①
(4)已知氯乙烷在碱性水溶液中有如下反应:CH3CH2Cl+H2O→CH3CH2OH+HCl.写出以乙烯为原料制取乙二醇( )的有关反应的化学方程式,注明反应条件.(无机试剂任选)(1)
)的有关反应的化学方程式,注明反应条件.(无机试剂任选)(1)
查看习题详情和答案>>
羧基
羧基
,-OH的电子式为

 +HNO3
+HNO3| 催化剂 |
| 加热 |
 +H2O
+H2O +HNO3
+HNO3| 催化剂 |
| 加热 |
 +H2O
+H2O(2)相对分子质量为72的烷烃的分子式是
C5H12
C5H12
,该烷烃在空气中燃烧的化学反应方程式是C5H12+8O2
5CO2+6H2O
| ||
C5H12+8O2
5CO2+6H2O
| ||
它可能的结构简式是
 、
、 、CH3CH2CH2CH2CH3
、CH3CH2CH2CH2CH3 、
、 、CH3CH2CH2CH2CH3
、CH3CH2CH2CH2CH3(3)在焊接铜漆包线时,常先把线头放在火上烧一下,以除去漆层,并立即在酒精中蘸一下才焊接,这是因为(用化学方程式表示):①
2Cu+O2
2CuO
| ||
2Cu+O2
2CuO
②
| ||
CuO+CH3CH2OH
Cu+CH3CHO+H2O
| ||
CuO+CH3CH2OH
Cu+CH3CHO+H2O
| ||
(4)已知氯乙烷在碱性水溶液中有如下反应:CH3CH2Cl+H2O→CH3CH2OH+HCl.写出以乙烯为原料制取乙二醇(
 )的有关反应的化学方程式,注明反应条件.(无机试剂任选)(1)
)的有关反应的化学方程式,注明反应条件.(无机试剂任选)(1)CH2═CH2+Cl2
CH2ClCH2Cl
| 催化剂 |
CH2═CH2+Cl2
CH2ClCH2Cl
(2)| 催化剂 |
CH2ClCH2Cl+2NaOH→CH2OHCH2OH+2NaCl
CH2ClCH2Cl+2NaOH→CH2OHCH2OH+2NaCl
.某同学利用MnO2、KClO3固体、AgNO3溶液、铜片四种物质及其反应产物完成了四种基本反应类型的实验,请写出有关反应的化学方程式:
①
②
③
④
查看习题详情和答案>>
①
分解反应为2KClO3
2KCl+3O2↑;
| ||
| △ |
分解反应为2KClO3
2KCl+3O2↑;
| ||
| △ |
②
复分解反应为KCl+AgNO3=AgCl↓+KNO3
复分解反应为KCl+AgNO3=AgCl↓+KNO3
③
化合反应为2Cu+O2
2CuO
| ||
化合反应为2Cu+O2
2CuO
| ||
④
置换反应为Cu+2AgNO3=Cu(NO3)2+2Ag
置换反应为Cu+2AgNO3=Cu(NO3)2+2Ag
.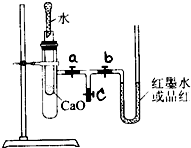 某校化学兴趣小组的同学按图所示将实验装置连接好,进行化学能与热能转化的实验探究.请帮他们回答下列问题:
某校化学兴趣小组的同学按图所示将实验装置连接好,进行化学能与热能转化的实验探究.请帮他们回答下列问题:实验前,在U型管内加入少量品红溶液(或红墨水).打开3个T型管螺旋夹,使U型管内两边的液面处于同一水平面,再夹紧螺旋夹.
(1)在内部的试管里盛1g氧化钙,当滴入2mL左右的蒸馏水后,打开a、b螺旋夹,可观察到U型管里的红墨水如何变化?
U型管里的红墨水向右移动,导致右侧液面高于左侧液面
U型管里的红墨水向右移动,导致右侧液面高于左侧液面
.(2)如果用这个装置观察到U型管内出现与上述(1)相反的现象,可在小试管中加入
NH4Cl或NH4NO3等铵盐
NH4Cl或NH4NO3等铵盐
固体后滴入适量的蒸馏水.(3)若向内部的试管中放入几小块铜片,再用滴管滴入10mL稀硝酸,能否得到(1)中现象?
能
能
,另外可观察到的现象是铜片表面有气泡冒出,过一会儿,试管口附近有红棕色气体出现,U型管里的红墨水向右移动
铜片表面有气泡冒出,过一会儿,试管口附近有红棕色气体出现,U型管里的红墨水向右移动
;产生上述现象的原因是铜片和稀硝酸反应生成NO,NO被氧气氧化为NO2;该反应放热,使大试管内气压增大,导致U型管里的红墨水向右移动
铜片和稀硝酸反应生成NO,NO被氧气氧化为NO2;该反应放热,使大试管内气压增大,导致U型管里的红墨水向右移动
;写出有关反应的化学方程式3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,2NO+O2=2NO2
3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,2NO+O2=2NO2
;由此可知,反应后产物的总能量小于
小于
(填“大于”、“小于”、“等于”)硝酸和铜片的总能量.此时该装置有明显的不足,原因是NO、NO2逸散到空气中,会造成环境污染
NO、NO2逸散到空气中,会造成环境污染
,改进的方法是在试管上加一双孔塞,用导气管将生成的气体导入到氢氧化钠溶液中
在试管上加一双孔塞,用导气管将生成的气体导入到氢氧化钠溶液中
.(2009?广东模拟)我国化工专家侯德榜的“侯氏制碱法”曾为世界制碱工业做出了突出贡献.他以NaCl、NH3、CO2等为原料先制得NaHCO3,进而生产出纯碱.有关反应的化学方程式为:
NH3+CO2+H2O=NH4HCO3;
NH4HCO3+NaCl=NaHCO3↓+NH4Cl;
2NaHCO3
Na2CO3+CO2↑+H2O
(1)碳酸氢铵与饱和食盐水反应,能析出碳酸氢钠晶体的原因是
a.碳酸氢钠难溶于水
b.碳酸氢钠受热易分解
c.碳酸氢钠的溶解度相对较小,所以在溶液中首先结晶析出
(2)某探究活动小组根据上述制碱原理,进行碳酸氢钠的制备实验,同学们按各自设计的方案实验.
①一位同学将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如下图所示(图中夹持、固定用的仪器未画出).

试回答下列有关问题:
(Ⅰ)乙装置中的试剂是
(Ⅱ)丁装置中稀硫酸的作用是
(Ⅲ)实验结束后,分离出NaHCO3 晶体的操作是
②另一位同学用图中戊装置(其它装置未画出)进行实验.
(Ⅰ)实验时,须先从
(Ⅱ)有同学建议在戊装置的b管下端连接己装置,理由是
(3)请你再写出一种实验室制取少量碳酸氢钠的方法:
查看习题详情和答案>>
NH3+CO2+H2O=NH4HCO3;
NH4HCO3+NaCl=NaHCO3↓+NH4Cl;
2NaHCO3
| ||
(1)碳酸氢铵与饱和食盐水反应,能析出碳酸氢钠晶体的原因是
C
C
a.碳酸氢钠难溶于水
b.碳酸氢钠受热易分解
c.碳酸氢钠的溶解度相对较小,所以在溶液中首先结晶析出
(2)某探究活动小组根据上述制碱原理,进行碳酸氢钠的制备实验,同学们按各自设计的方案实验.
①一位同学将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如下图所示(图中夹持、固定用的仪器未画出).

试回答下列有关问题:
(Ⅰ)乙装置中的试剂是
饱和碳酸氢钠溶液
饱和碳酸氢钠溶液
;(Ⅱ)丁装置中稀硫酸的作用是
吸收未反应的NH3
吸收未反应的NH3
;(Ⅲ)实验结束后,分离出NaHCO3 晶体的操作是
过滤
过滤
(填分离操作的名称).②另一位同学用图中戊装置(其它装置未画出)进行实验.
(Ⅰ)实验时,须先从
a
a
管通入NH3
NH3
气体,再从b
b
管中通入CO2
CO2
气体;(Ⅱ)有同学建议在戊装置的b管下端连接己装置,理由是
增大气体与溶液接触面积,提高CO2吸收率
增大气体与溶液接触面积,提高CO2吸收率
;(3)请你再写出一种实验室制取少量碳酸氢钠的方法:
用碳酸氢铵与适量饱和食盐水反应或往烧碱溶液中通入过量CO2;或往饱和Na2CO3溶液中通入过量CO2等
用碳酸氢铵与适量饱和食盐水反应或往烧碱溶液中通入过量CO2;或往饱和Na2CO3溶液中通入过量CO2等
.
