网址:http://m.1010jiajiao.com/timu3_id_175604[举报]
(1)根据元素周期律预测:酸性强弱H3AsO4 H3PO4(用“>”或“<”表示).
(2)元素Se的最高正价和最低负价的代数和为 ;在一定条件下,S与H2反应有一定限度(可理解为反应进行的程度),请判断:在相同条件下Se与H2反应的限度比S与H2反应的限度 (选填“大”、“小”或“相同”).
(3)I2具有一定的氧化性,SO2具有较强的还原性,将适量SO2气体通入碘水后,溶液中主要存在的离子是 .
(4)下列说法不正确的是 (填序号).
a.C、N、O、F的原子半径随着原子序数的增大而减小
b.Si、P、S、Cl元素的非金属性随着核电荷数的增加而增强
c.干冰升华、水蒸气的液化都要吸热
d.HF、HCl、HBr、HI的热稳定性依次减弱.
 查看习题详情和答案>>
查看习题详情和答案>>
能源的开发、利用与人类社会的可持续发展息息相关,充分利用好能源是摆在人类面前的重大课题。
Ⅰ.已知:①Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g) ΔH=a kJ·mol-1
②CO(g)+l/2O2(g)=CO2(g) ΔH=b kJ·mol-1
③C(石墨)+O2(g)=CO2(g) ΔH=c kJ·mol-1
则反应4Fe(s)+3O2(g)=2Fe2O3(s)的焓变ΔH= kJ·mol-1。
Ⅱ.依据原电池的构成原理,下列化学反应在理论上可以设计成原电池的是 (填序号)。
A.C(s)+CO2(g)=2CO(g) ΔH>0 B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ΔH<0
C.2H2O(l)=2H2(g)+O2(g) ΔH>0 D.CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH<0
若以稀硫酸为电解质溶液,则该原电池的正极反应式为 。
Ⅲ.氢气作为一种绿色能源,对于人类的生存与发展具有十分重要的意义。
(1)实验测得,在通常情况下,1 g H2完全燃烧生成液态水,放出142.9 kJ热量。则H2燃烧的热化学方程式为 。
(2)用氢气合成氨的热化学方程式为N2(g)+3H2(g)  2NH3(g) ΔH=-92.4 kJ·mol-1
2NH3(g) ΔH=-92.4 kJ·mol-1
①一定条件下,下列叙述可以说明该反应已达平衡状态的是 。
A.υ正(N2)=υ逆(NH3)
B.各物质的物质的量相等
C.混合气体的物质的量不再变化
D.混合气体的密度不再变化
②下图表示合成氨反应达到平衡后,每次只改变温度、压强、催化剂中的某一条件,反应速率υ与时间t的关系。其中表示平衡混合物中的NH3的含量最高的一段时间是 。图中t3时改变的条件可能是 。

③温度为T℃时,将4a mol H2和2a mol N2放入0.5 L密闭容器中,充分反应后测得N2的转化率为50%,则反应的平衡常数为 。
查看习题详情和答案>>
 氯气是氯碱工业的主要产品之一,是一种常用的消毒剂,其消毒原理是与水反应生成了次氯酸:
氯气是氯碱工业的主要产品之一,是一种常用的消毒剂,其消毒原理是与水反应生成了次氯酸:Cl2+H2O?HCl+HC10K=4.5×10-4
次氯酸的强氧化性能杀死水中的病菌(不直接用次氯酸为自来水消毒是因为次氯酸易分解,且毒性较大).但是,由于氯气贮运不方便,且具有一定的危险性,目前正逐渐被其他性能优越的消毒产品所替代.请回答:
(1)氯碱工业生产氯气的化学方程式为
| ||
| ||
(2)84消毒液与氯气相比具有贮运方便等优点,用氯气与烧碱溶液反应制备84消毒液的离子方程式为
(3)二氧化氯是目前国际上公认的最新一代的高效、广谱、安全的杀菌、保鲜剂.我国科学家研发了用氯气氧化亚氯酸钠(NaClO2)固体制备二氧化氯的方法,其化学方程式为
(4)一位同学设计了一套用浓盐酸和KMnO4固体制取少量氯气并比较氯气与碘单质的氧化性强弱的微型装置(如图).
①下列溶液能吸收Cl2的是
A.饱和食盐水 B.饱和Na2SO3溶液
C.饱和NaOH溶液 D.浓硫酸
②能说明Cl2的氧化性强于I2的实验现象是
③Cl2中含有少量HCl气体,可用
(12分)
(1)现有A、B、C、D、E五种元素,A的原子核中没有中子;B、C元素处于同一周期,C的原子半径较小,B、C的质子数之和为27,质子数之差为5; D的单质跟盐酸反应,生成D3+和氢气;E和C能形成E2C型离子化合物,且E、C两元素的简单离子具有相同电子层结构。
①写出元素符号:
A ,C ,E 。
② B、D的最高价氧化物对应水化物相互反应的离子方程式为:
。
③写出E2C的电子式: 。
(2)元素在周期表中的位置,反映了元素的原子结构和元素的性质。下图是元素周期表的一部分。
①阴影部分元素N在元素周期表中的位置为第 周期第 族。
根据元素周期律,预测:酸性强弱 H3AsO4 H3PO4。(用“>”或“<”表示)
②元素S的最高正价和最低负价的代数和为____________,在一定条件下,S与H2反应有一定限度(可理解为反应进行的程度),请判断:在相同条件下Se与H2反应的限度比S与H2反应限度 。(选填“更大”、“更小”或“相同”)
③ Br2具有较强的氧化性,SO2具有较强的还原性,将SO2气体通入溴水后,溶液中存在的主要离子是________________________________________________。
④下列说法正确的是
A.C、N、O、F的原子半径随着原子序数的增大而减小
B.Si、P、S、Cl元素的非金属性随着核电荷数的增加而增强
C.干冰升华、液态水转变为气态都要克服分子内的共价键
D.HF、HCl、HBr、HI的热稳定性依次减弱
(12分)
(1)现有A、B、C、D、E五种元素,A的原子核中没有中子;B、C元素处于同一周期,C的原子半径较小,B、C的质子数之和为27,质子数之差为5; D的单质跟盐酸反应,生成D3+和氢气;E和C能形成E2C型离子化合物,且E、C两元素的简单离子具有相同电子层结构。
① 写出元素符号:
A ,C ,E 。
② B、D的最高价氧化物对应水化物相互反应的离子方程式为:
。
③ 写出E2C的电子式: 。
(2)元素在周期表中的位置,反映了元素的原子结构和元素的性质。下图是元素周期表的一部分。
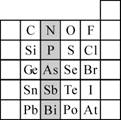
① 阴影部分元素N在元素周期表中的位置为第 周期第 族。
根据元素周期律,预测:酸性强弱 H3AsO4 H3PO4。(用“>”或“<”表示)
② 元素S的最高正价和最低负价的代数和为____________,在一定条件下,S与H2反应有一定限度(可理解为反应进行的程度),请判断:在相同条件下Se与H2反应的限度比S与H2反应限度 。(选填“更大”、“更小”或“相同”)
③ Br2具有较强的氧化性,SO2具有较强的还原性,将SO2气体通入溴水后,溶液中存在的主要离子是________________________________________________。
④ 下列说法正确的是
A.C、N、O、F的原子半径随着原子序数的增大而减小
B.Si、P、S、Cl元素的非金属性随着核电荷数的增加而增强
C.干冰升华、液态水转变为气态都要克服分子内的共价键
D.HF、HCl、HBr、HI的热稳定性依次减弱
查看习题详情和答案>>