摘要:5.C解析:一般而言.酸性氧化物不与酸起反应.但SiO2与HF的反应是此规律的特例.由二氧化硅的化学性质知.SiO2能与NaOH.HF.CaO反应.但不能与HNO3反应.
网址:http://m.1010jiajiao.com/timu3_id_175329[举报]
能说明元素X的非金属性强于元素Y的事实是( )
| A、元素周期表中元素X位于元素Y的上一个周期 | B、相同条件下,分别加热H2X和HY,HY先发生分解 | C、元素X的含氧酸的酸性强于元素Y的含氧酸 | D、X元素原子最外层电子数比Y元素原子的多 |
X、Y是第三周期主族元素,电负性:X>Y,下列说法错误的是( )
| A、Y的电离能一定比X的小 | B、Y的气态氢化物的稳定性一定比X的差 | C、Y的最高价含氧酸的酸性一定比X的小 | D、X与Y若形成化合物,X一定显负价 |
 维生素C主要存在于蔬菜、水果中,它能增加人体对疾病的抵抗能力.其结构简式如图,请回答:
维生素C主要存在于蔬菜、水果中,它能增加人体对疾病的抵抗能力.其结构简式如图,请回答:(1)维生素C的分子式是
C6H8O6
C6H8O6
,其分子中不含氧的官能团的名称是碳碳双键
碳碳双键
.(2)维生素C可发生的化学反应有
①②③
①②③
(填序号).①加成反应;②氧化反应;③取代反应
(3)向维生素C的水溶液中滴加紫色石蕊试液,试液变红,说明维生素C的水溶液显
酸
酸
性.(2013?南昌三模)某兴趣小组挤究SO2气体还原Fe3+、I2,他们使用的药品和装置如下图所示:
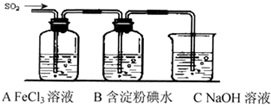
(1)SO2气体还原Fe3+反应的产物是
(2)下列实验方案可以用于在实验室制取所需SO2的是
A.Na2SO3溶液与HNO3 B.Na2SO3固体与浓硫酸 C.固体硫在纯氧中燃烧 D.铜与热浓H2SO4
(3)装置C的作用是
(4)如果有280mL SO2气体(已折算为标态)进入C装置中,则C中,50mL NaOH溶液的浓度至少为
(5)在上述装置中通入过量的SO2为了验证A中SO2与Fe3+发生了氧化还原反应,他们取A中的溶液,分成三份,并设计了如下实验:
方案①:往第一份试液中加入KMnO4溶液,紫红色褪去.
方案@:往第一份试液加入KSCN溶液,不变红,再加入新制的氯水,溶液变红.
方案③:往第二份试液加入用稀盐酸酸化的BaCl2,产生白色沉淀.
上述方案不合理的是
(6)能表明I-的还原性弱于SO2的现象是
查看习题详情和答案>>

(1)SO2气体还原Fe3+反应的产物是
Fe2+
Fe2+
、SO42-
SO42-
(填离子符号).(2)下列实验方案可以用于在实验室制取所需SO2的是
BD
BD
.A.Na2SO3溶液与HNO3 B.Na2SO3固体与浓硫酸 C.固体硫在纯氧中燃烧 D.铜与热浓H2SO4
(3)装置C的作用是
除去多余的SO2,防止污染空气
除去多余的SO2,防止污染空气
.(4)如果有280mL SO2气体(已折算为标态)进入C装置中,则C中,50mL NaOH溶液的浓度至少为
0.25
0.25
mol/L才能达到目的.(5)在上述装置中通入过量的SO2为了验证A中SO2与Fe3+发生了氧化还原反应,他们取A中的溶液,分成三份,并设计了如下实验:
方案①:往第一份试液中加入KMnO4溶液,紫红色褪去.
方案@:往第一份试液加入KSCN溶液,不变红,再加入新制的氯水,溶液变红.
方案③:往第二份试液加入用稀盐酸酸化的BaCl2,产生白色沉淀.
上述方案不合理的是
①
①
,原因是SO2、Fe2+都能使酸性高锰酸钾褪色
SO2、Fe2+都能使酸性高锰酸钾褪色
.(6)能表明I-的还原性弱于SO2的现象是
B中蓝色褪去
B中蓝色褪去
,写出有关离子方程式:I2+SO2+2H2O→4H++2I-+SO42-
I2+SO2+2H2O→4H++2I-+SO42-
.