摘要:由CuS.Ag2O组成的黑色粉末中.已知氧的质量分数为4%.求此混和物中其它元素的质量分数.两物质的质量比及物质的量之比.
网址:http://m.1010jiajiao.com/timu3_id_174555[举报]
已知由短周期元素组成的六种微粒A、B、C、D、E、F其所含原子核数目依次为2、3、4、5、1、1.其中A、B、E各含有18个电子,C、D、F各含有10个电子,A、B、C、D为常见化合物.请回答:
(1)D分子的空间构型为
(2)将B缓慢通入Cu(OH)2悬浊液中,浑浊液变为黑色,相应的化学方程式为
(3)A、C混合可生成一种新的化合物,该化合物中含有的化学键类型有
(4)①若E、F可按1:1组成离子化合物X,其水溶液呈中性.请写出电解X溶液的化学方程式:
②若Y溶液中所有离子间有以下关系:c(H+)+3c(F)=c(OH-)+c(E),则:Y溶液的pH
查看习题详情和答案>>
(1)D分子的空间构型为
正四面体
正四面体
.(2)将B缓慢通入Cu(OH)2悬浊液中,浑浊液变为黑色,相应的化学方程式为
H2S+Cu(OH)2=CuS+2H2O
H2S+Cu(OH)2=CuS+2H2O
.(3)A、C混合可生成一种新的化合物,该化合物中含有的化学键类型有
离子键、共价键
离子键、共价键
;室温下,将pH=a的C的稀溶液与pH=14-a的A稀溶液等体积混合,所得溶液中各离子浓度由大到小的顺序为c(NH4+)>c(Cl-)>c(OH-)>c(H+)
c(NH4+)>c(Cl-)>c(OH-)>c(H+)
.(4)①若E、F可按1:1组成离子化合物X,其水溶液呈中性.请写出电解X溶液的化学方程式:
2NaCl+2H2O
H2↑+Cl2↑+2NaOH
| ||
2NaCl+2H2O
H2↑+Cl2↑+2NaOH
;电解时,阳极收集到的气体体积小于阴极,原因是
| ||
部分Cl2与NaOH溶液发生了反应而消耗
部分Cl2与NaOH溶液发生了反应而消耗
.②若Y溶液中所有离子间有以下关系:c(H+)+3c(F)=c(OH-)+c(E),则:Y溶液的pH
小于
小于
7(填“大于”、“小于”或“等于”),原因是(用离子方程式表示)Al3++3H2O?Al(OH)3+3H+
Al3++3H2O?Al(OH)3+3H+
.X、Y、V、W是常见的短周期元素,它们在周期表里的位置如下图所示.V、W的最简单的气态氢化物M、N混合时有白烟生成,M是碱性气体.请回答以下问题:
(1)W的原子结构示意图为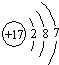
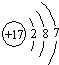 .
.
(2)常温常压下,将a L M气体和b L N气体通入水中,若所得溶液的pH=7,则a
(3)二氧化钛(TiO2)与X的单质、Y的单质在高温下反应,生成由两种元素组成的两种化合物,该反应的化学方程式为
(4)联氨(N2H4)也叫肼,是火箭的燃料写出肼的结构式
 ,用次氯酸钠溶液氧化M能得到肼的稀溶液,写出反应的离子方程式
,用次氯酸钠溶液氧化M能得到肼的稀溶液,写出反应的离子方程式
(5)含X元素的一种化合物A与Y的最高价氧化物B之间有右图的转化关系,若D为白色沉淀,则如图转化的离子方程式为

查看习题详情和答案>>
| Y | V | |||
| X | W |
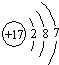
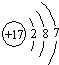
(2)常温常压下,将a L M气体和b L N气体通入水中,若所得溶液的pH=7,则a
>
>
b(填“>、=、<”)(3)二氧化钛(TiO2)与X的单质、Y的单质在高温下反应,生成由两种元素组成的两种化合物,该反应的化学方程式为
3TiO2+4Al+3C
2Al2O3+3TiC
| ||
3TiO2+4Al+3C
2Al2O3+3TiC
.
| ||
(4)联氨(N2H4)也叫肼,是火箭的燃料写出肼的结构式


ClO-+2NH3=N2H4+Cl-+H2O
ClO-+2NH3=N2H4+Cl-+H2O
.(5)含X元素的一种化合物A与Y的最高价氧化物B之间有右图的转化关系,若D为白色沉淀,则如图转化的离子方程式为
AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-或2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-
AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-或2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-
. 
 (2011?怀柔区模拟)甲、乙、丙、丁是由短周期元素组成的物质,反应如下:甲+乙→丙+丁
(2011?怀柔区模拟)甲、乙、丙、丁是由短周期元素组成的物质,反应如下:甲+乙→丙+丁(1)若甲为块状固体,丙分子内同时具有极性键和非极性键可燃性气体,乙为水,则丙的结构式
H-C≡C-H
H-C≡C-H
.(2)若甲和丁是同主族元素组成的单质,乙为水.且甲的组成元素位于第三周期,反应的离子方程式
2Na+2H2O=2Na++2OH-+H2↑
2Na+2H2O=2Na++2OH-+H2↑
.(3)霍夫曼用上述反应测定了氨分子的组成.用图3装置实验,打开分液漏斗活塞,滴下浓氨水至不再反应为止;关闭活塞,待恢复至室温,打开止水夹,试管内液面上升至
| 2 | 3 |
产生大量白烟,黄绿色气体消失
产生大量白烟,黄绿色气体消失
反应化学方程式:8NH3+3Cl2=N2+6NH4Cl
8NH3+3Cl2=N2+6NH4Cl
(4)若甲Cl2,乙为NH4Cl反应,丁为HCl,丙为氮的氯化物,当消耗6.72L Cl2(标状)时得到0.10mol氮的氯化物,丙的化学式
NCl3
NCl3
,反应方程式3Cl2+NH4Cl═NCl3+4HCl
3Cl2+NH4Cl═NCl3+4HCl
. 北京奥运金牌“金玉合璧”上的环形玉是产自新疆的和田玉,和田玉是一种具有链状结构的含水钙镁硅酸盐.某种和田玉的化学成分为Ca2Mg3Fe2(Si4O11)2(OH)2,下列有关叙述中正确的是( )
北京奥运金牌“金玉合璧”上的环形玉是产自新疆的和田玉,和田玉是一种具有链状结构的含水钙镁硅酸盐.某种和田玉的化学成分为Ca2Mg3Fe2(Si4O11)2(OH)2,下列有关叙述中正确的是( )| A、将该和田玉的化学式改写成氧化物的形式表示如下:2CaO?3MgO?Fe2O3?8SiO2?H2O | B、该和田玉能抵抗任何酸或碱的腐蚀 | C、该和田玉中Fe的化合价为+2价 | D、该和田玉是由5种氧化物组成的混合物 |