摘要: A .B [ Cl ] .C 氢 .D O .
网址:http://m.1010jiajiao.com/timu3_id_173409[举报]
已知A、B、C、D、E、F都是短周期的元素,它们的原子序数依次递增.A原子的电子层数与它的核外电子总数相同,而B原子的最外层电子数是次外层的2倍,C的氢化物可使湿润的红色石蕊试纸变蓝,B和D可以形成两种气态化合物,E原子核外电子总数比B的2倍少1,F在本周期元素中原子半径最小.则:
(1)A、B、C、D、E、F的名称分别是
(2)在A至F中任选元素,写出二种含极性键的非极性分子的结构式
 .
.
(3)由B和D组成,且B和D的质量比为3:8的化合物的电子式是
 ,该物质与E的同周期相邻主族元素的单质反应的化学方程式为
,该物质与E的同周期相邻主族元素的单质反应的化学方程式为
(4)F单质与E的最高价氧化物的水化物反应的离子方程式为
(5)将8g BA4完全燃烧后恢复到室温,放出热量a kJ,写出表示BA4的燃烧热的热化学方程式
查看习题详情和答案>>
(1)A、B、C、D、E、F的名称分别是
氢、碳、氮、氧、钠、氯
氢、碳、氮、氧、钠、氯
.(2)在A至F中任选元素,写出二种含极性键的非极性分子的结构式
O=C=O、 、
、 (任写两种)
(任写两种)
 、
、 (任写两种)
(任写两种)O=C=O、 、
、 (任写两种)
(任写两种)
,写出一种含非极性键的离子化合物的电子式 、
、 (任写两种)
(任写两种)

(3)由B和D组成,且B和D的质量比为3:8的化合物的电子式是


CO2+2Mg
C+2MgO
| ||
CO2+2Mg
C+2MgO
| ||
(4)F单质与E的最高价氧化物的水化物反应的离子方程式为
2OH-+Cl2=Cl-+ClO-+H2O
2OH-+Cl2=Cl-+ClO-+H2O
.(5)将8g BA4完全燃烧后恢复到室温,放出热量a kJ,写出表示BA4的燃烧热的热化学方程式
CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-2akJ/mol
CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-2akJ/mol
.【化学--选修:有机化学基础】分别由C、H、O三种元素组成的有机物A、B、C互为同分异构体,它们分子中C、H、O元素的质量比为15:2:8,其中化合物A的质谱图如下图.
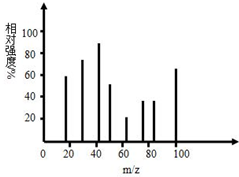
A是直链结构,其核磁共振氢谱有三组峰,且峰面积之比为1:1:2,它能够发生银镜反应.B为五元环
酯.C的红外光谱表明其分子中存在甲基.其它物质的转化关系如下图:
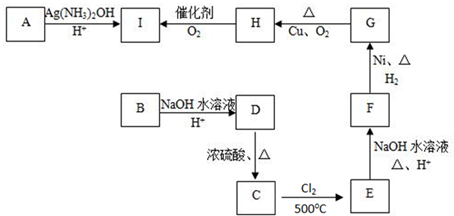
已知:CH3CH═CH2
Cl-CH2CH=CH2
(1)A的分子式是: .A分子中的官能团名称是: .
(2)B和G的结构简式分别是: 、 .
(3)写出下列反应方程式(有机物用结构简式表示)
D→C
H→G .
(4)写出由单体F分别发生加聚反应生成的产物和发生缩聚反应生成的产物的结构简式: 、 .
查看习题详情和答案>>

A是直链结构,其核磁共振氢谱有三组峰,且峰面积之比为1:1:2,它能够发生银镜反应.B为五元环
酯.C的红外光谱表明其分子中存在甲基.其它物质的转化关系如下图:

已知:CH3CH═CH2
| Cl2 | 500℃ |
(1)A的分子式是:
(2)B和G的结构简式分别是:
(3)写出下列反应方程式(有机物用结构简式表示)
D→C
H→G
(4)写出由单体F分别发生加聚反应生成的产物和发生缩聚反应生成的产物的结构简式:
下图为某些常见物质之间的转化关系.已知:A、B、I中含有相同的阳离子且都是XY2型化合物,且I是实验室常用的干燥剂;C为直线型分子;E、F为非金属气体单质.
请按要求填空:

(1)①B的电子式是
 ,②K的结构式是
,②K的结构式是
(2)D与G反应的化学方程式是
(3)已知C的燃烧热是1300kJ/mol,表示C的燃烧热的热化学方程式是
(4)将G溶于水配成溶液,简述检验该溶液G中所含阳离子的操作方法:
(5)常温下0.1mol/L的J溶液中c(H+)/c(OH-)=1×10-8,下列叙述错误的是
A.该溶液的pH=11;
B.该溶液中的溶质电离出的阳离子浓度0.1mol/L
C.该溶液中水电离出的c(H+)与c(OH-)乘积为1×10-22
D.pH=3的盐酸溶液V1 L与该0.1mol/L的J溶液V2 L混合,若混合溶液pH=7,则:V1>V2
E.将以上溶液加水稀释100倍后,pH值为9;
(6)单质F在工业上有重要的用途是
查看习题详情和答案>>
请按要求填空:

(1)①B的电子式是


H-O-Cl
H-O-Cl
;(2)D与G反应的化学方程式是
2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O
| ||
2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O
;
| ||
(3)已知C的燃烧热是1300kJ/mol,表示C的燃烧热的热化学方程式是
C2H2(g)+
O2(g)=2CO2(g)+H2O(l)△H=-1300kJ/mol
| 5 |
| 2 |
C2H2(g)+
O2(g)=2CO2(g)+H2O(l)△H=-1300kJ/mol
;| 5 |
| 2 |
(4)将G溶于水配成溶液,简述检验该溶液G中所含阳离子的操作方法:
取少量的G溶液于试管中,加入适量的氢氧化钠溶液,加热试管,将湿润的红色石蕊试纸放在试管口,若试纸变成蓝色,则含有NH4+,(其他合理答案均给分)
取少量的G溶液于试管中,加入适量的氢氧化钠溶液,加热试管,将湿润的红色石蕊试纸放在试管口,若试纸变成蓝色,则含有NH4+,(其他合理答案均给分)
;(5)常温下0.1mol/L的J溶液中c(H+)/c(OH-)=1×10-8,下列叙述错误的是
BCE
BCE
;A.该溶液的pH=11;
B.该溶液中的溶质电离出的阳离子浓度0.1mol/L
C.该溶液中水电离出的c(H+)与c(OH-)乘积为1×10-22
D.pH=3的盐酸溶液V1 L与该0.1mol/L的J溶液V2 L混合,若混合溶液pH=7,则:V1>V2
E.将以上溶液加水稀释100倍后,pH值为9;
(6)单质F在工业上有重要的用途是
制漂白粉,制盐酸(制漂白液等)
制漂白粉,制盐酸(制漂白液等)
.(至少两种)2008年5月17日新疆电视台(午间新闻)报道:我国新增阿勒泰大气背景监测点。这标志着气候条件独特、空气质量优良的新疆阿勒泰市已成为我国第8个国家大气背景监测点。监测点安装的监测设备可日常监测二氧化硫、二氧化氮、一氧化氮及臭氧等污染物。NO分子因污染空气而臭名昭著,近年来,发现少量的NO在生物体内许多组织中存在,它有扩张血管、免疫、增强记忆的功能,而成为当前生命科学的研究热点,NO亦被称为“明星分子”。请回答下列问题。
(1)NO对环境的危害在于________(填编号)。
A.破坏臭氧层 B.高温下能使一些金属氧化 C.造成酸雨 D.与人体血红蛋白结合
(2)在含Cu+的酶的活化中心,亚硝酸根离子(NO2-)可转化为NO,写出Cu+和亚硝酸根离子在酸性水溶液中反应的离子方程式: ____________________________。
(3)“绿色奥运”是2008年北京奥运会的主题之一,为迎接奥运,减少空气污染,北京为汽车加装了“三效催化净化器”,可将尾气中的一氧化碳和一氧化氮转化为参与大气循环的无毒混合气体,该气体是__________
A.二氧化碳和氮气 B.二氧化碳和二氧化氮 C.二氧化碳和氧气 D.二氧化碳和氢气
(4)氟利昂(如CCl2F2)可在光的作用下分解,产生氯原子,氯原子会对臭氧层产生长久的破坏作用(臭氧的分子式为O3)。有关反应如下:
O3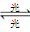 O2+O Cl+O3→ClO+O2 ClO+O→Cl+O2
O2+O Cl+O3→ClO+O2 ClO+O→Cl+O2
总反应:2O3→3O2,在上述臭氧变成氧气的反应过程中,Cl是____________。
查看习题详情和答案>>
(1)NO对环境的危害在于________(填编号)。
A.破坏臭氧层 B.高温下能使一些金属氧化 C.造成酸雨 D.与人体血红蛋白结合
(2)在含Cu+的酶的活化中心,亚硝酸根离子(NO2-)可转化为NO,写出Cu+和亚硝酸根离子在酸性水溶液中反应的离子方程式: ____________________________。
(3)“绿色奥运”是2008年北京奥运会的主题之一,为迎接奥运,减少空气污染,北京为汽车加装了“三效催化净化器”,可将尾气中的一氧化碳和一氧化氮转化为参与大气循环的无毒混合气体,该气体是__________
A.二氧化碳和氮气 B.二氧化碳和二氧化氮 C.二氧化碳和氧气 D.二氧化碳和氢气
(4)氟利昂(如CCl2F2)可在光的作用下分解,产生氯原子,氯原子会对臭氧层产生长久的破坏作用(臭氧的分子式为O3)。有关反应如下:
O3
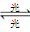 O2+O Cl+O3→ClO+O2 ClO+O→Cl+O2
O2+O Cl+O3→ClO+O2 ClO+O→Cl+O2总反应:2O3→3O2,在上述臭氧变成氧气的反应过程中,Cl是____________。
如图1是元素周期表的一部分.
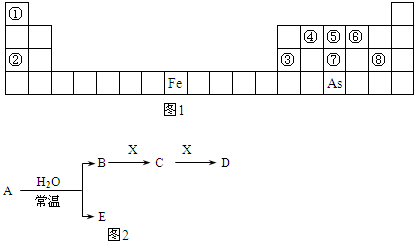
Ⅰ.用化学用语回答下列问题:
(1)②、⑥、⑧的离子半径由大到小的顺序为
(2)④、⑦、⑧的最高价含氧酸的酸性由强到弱的顺序是
(3)As的原子结构示意图为
 ;其氢化物的化学式为
;其氢化物的化学式为
(4)Y由②⑥⑧三种元素组成,它的水溶液是生活中常见的消毒剂.As可与Y的水溶液反应,产物有As的最高价含氧酸,该反应的化学方程式为
Ⅱ.A、B、C、D、E、X是上述周期表给出元素组成的常见单质或化合物.已知A、B、C、D、E、X存在如图2所示转化关系(部分生成物和反应条件略去).
若常温下A为红棕色气体,B为强酸,X为常见金属单质
(5)A与水反应的化学方程式为
(6)工业上常用热还原法冶炼X,写出其化学方程式
(7)某温度下(>100℃)若m克X与H2O反应放出QKJ (Q>O)的热量.写出该反应的热化学方程式
(8)少量X与B的稀溶液反应生成C的离子反应方程式为
查看习题详情和答案>>

Ⅰ.用化学用语回答下列问题:
(1)②、⑥、⑧的离子半径由大到小的顺序为
Clˉ>O2ˉ>Na+
Clˉ>O2ˉ>Na+
.(2)④、⑦、⑧的最高价含氧酸的酸性由强到弱的顺序是
HClO4>H3PO4>H2CO3
HClO4>H3PO4>H2CO3
.(3)As的原子结构示意图为


AsH3
AsH3
.(4)Y由②⑥⑧三种元素组成,它的水溶液是生活中常见的消毒剂.As可与Y的水溶液反应,产物有As的最高价含氧酸,该反应的化学方程式为
5NaClO+2As+3H2O═2H3AsO4+5NaCl
5NaClO+2As+3H2O═2H3AsO4+5NaCl
,当消耗1mol还原剂时,电子转移了5
5
mol.Ⅱ.A、B、C、D、E、X是上述周期表给出元素组成的常见单质或化合物.已知A、B、C、D、E、X存在如图2所示转化关系(部分生成物和反应条件略去).
若常温下A为红棕色气体,B为强酸,X为常见金属单质
(5)A与水反应的化学方程式为
3NO2+H2O=2HNO3+NO
3NO2+H2O=2HNO3+NO
.(6)工业上常用热还原法冶炼X,写出其化学方程式
Fe2O3+3CO
2Fe+3CO2
| ||
Fe2O3+3CO
2Fe+3CO2
.
| ||
(7)某温度下(>100℃)若m克X与H2O反应放出QKJ (Q>O)的热量.写出该反应的热化学方程式
3Fe(s)+4H2O(g)═Fe3O4(s)+4H2(g)△H=-
kJ/mol
| 168Q |
| m |
3Fe(s)+4H2O(g)═Fe3O4(s)+4H2(g)△H=-
kJ/mol
.| 168Q |
| m |
(8)少量X与B的稀溶液反应生成C的离子反应方程式为
Fe+4H++NO3ˉ=Fe3++NO↑+2H2O
Fe+4H++NO3ˉ=Fe3++NO↑+2H2O
.