摘要:(二) 称量:
网址:http://m.1010jiajiao.com/timu3_id_173393[举报]
二甲醚(CH3OCH3)被称为21世纪的清洁、高效能源.
Ⅰ.(1)合成二甲醚反应一:
3H2(g)+2CO(g)?CH3OCH3(g)+CO2(g)△H=-247KJ/mol
一定条件下该反应在密闭容器中达到平衡后,要提高CO的转化率,可以采取的措施是
A、低温高压 B、加催化剂 C、体积不变充入N2
D、增加CO浓度 E、分离出二甲醚
(2)合成二甲醚反应二:2CH3OH(g)?CH3OCH3(g)+H2O(g).在不同温度下,分别在1L密闭容器中加入不同物质的量的CH3OH,反应达到平衡,测得各组分的浓度如表:‘
该反应是
Ⅱ.二甲醚燃料电池的工作原理如下图一所示.

(1)该电池正极的电极反应式为
电池在放电过程中,b对应的电极溶液的pH
(2)以上述电池为电源,通过导线与图二电解池相连.X、Y为石墨,a为1L0.1mol/LKCl溶液,写出电解总反应的离子方程式为
(3)室温时,按上述(2)电解一段时间后,取25mL上述电解后溶液,滴加0.2mol/L 醋酸得到图三(不考虑能量损失和气体溶于水,溶液体积变化忽略不计).
①若图三的B点pH=7,则滴定终点在
②C点溶液中各离子浓度大小关系是
查看习题详情和答案>>
Ⅰ.(1)合成二甲醚反应一:
3H2(g)+2CO(g)?CH3OCH3(g)+CO2(g)△H=-247KJ/mol
一定条件下该反应在密闭容器中达到平衡后,要提高CO的转化率,可以采取的措施是
AE
AE
.A、低温高压 B、加催化剂 C、体积不变充入N2
D、增加CO浓度 E、分离出二甲醚
(2)合成二甲醚反应二:2CH3OH(g)?CH3OCH3(g)+H2O(g).在不同温度下,分别在1L密闭容器中加入不同物质的量的CH3OH,反应达到平衡,测得各组分的浓度如表:‘
| 实验组 | 温度/K | 平衡浓度mol/L | ||
| CH3OH | CH3OCH3 | H2O | ||
| 1 | 403 | 0.01 | 0.2 | 0.2 |
| 2 | 453 | 0.02 | 0.3 | 0.4 |
放热
放热
(填“放热”或“吸热”)反应,原因是K(403)=
=400,K(453)=
=300,K(403)>K(453),所以该反应为放热反应
| 0.2×0.2 |
| (0.01)2 |
| 0.3×0.4 |
| (0.02)2 |
K(403)=
=400,K(453)=
=300,K(403)>K(453),所以该反应为放热反应
(从平衡常数角度说明).| 0.2×0.2 |
| (0.01)2 |
| 0.3×0.4 |
| (0.02)2 |
Ⅱ.二甲醚燃料电池的工作原理如下图一所示.

(1)该电池正极的电极反应式为
4H++O2+4e-=2H2O
4H++O2+4e-=2H2O
.电池在放电过程中,b对应的电极溶液的pH
减小
减小
.(填“增大”、“减小”或“不变”)(2)以上述电池为电源,通过导线与图二电解池相连.X、Y为石墨,a为1L0.1mol/LKCl溶液,写出电解总反应的离子方程式为
2Cl-+2H2O
Cl2↑+H2↑+2OH-
| ||
2Cl-+2H2O
Cl2↑+H2↑+2OH-
.
| ||
(3)室温时,按上述(2)电解一段时间后,取25mL上述电解后溶液,滴加0.2mol/L 醋酸得到图三(不考虑能量损失和气体溶于水,溶液体积变化忽略不计).
①若图三的B点pH=7,则滴定终点在
AB
AB
区间(填“AB”、“BC”或“CD”).②C点溶液中各离子浓度大小关系是
c(CH3COO-)>c(K+)>c(H+)>c(OH-)
c(CH3COO-)>c(K+)>c(H+)>c(OH-)
.二甲醚(CH3OCH3)被称为21世纪的新型能源,是一种高效、清洁能源.
Ⅰ.工业制备二甲醚的生产流程如下:
催化反应室中(压力2.0~10.0Mpa,温度230~280℃)发生如下反应:
①CO(g)+2H2(g)?CH3OH(g)△H=-90.7kJ/mol
②2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=-23.5kJ/mol
③CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.2kJ/mol
(1)二甲醚也可以通过天然气和CO2合成制得,该反应的化学方程式为
(2)催化反应室中总反应3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g)的△H=
(3)在温度相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒压,发生反应②,测得反应达到平衡时的有关数据如下.
下列说法正确的是
A.a+2c=23.5 B.α1+α2=1 C.V1>V3 D.c1=2c3
(4)上述生产流程中,可以循环使用的物质有
Ⅱ.用二甲醚-空气碱性(KOH)燃料电池作电源电解精炼粗铜(如图),在接通电路一段时间纯Cu质量增加3.2g.

(5)请写出燃料电池中的负极反应式:
(6)燃料电池正极消耗标准状况下空气的体积是
查看习题详情和答案>>
Ⅰ.工业制备二甲醚的生产流程如下:

催化反应室中(压力2.0~10.0Mpa,温度230~280℃)发生如下反应:
①CO(g)+2H2(g)?CH3OH(g)△H=-90.7kJ/mol
②2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=-23.5kJ/mol
③CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.2kJ/mol
(1)二甲醚也可以通过天然气和CO2合成制得,该反应的化学方程式为
3CH4+CO2→2CH3OCH3
3CH4+CO2→2CH3OCH3
.(2)催化反应室中总反应3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g)的△H=
-246.1kJ/mol
-246.1kJ/mol
,830℃时反应③的K=1.0,则在催化反应室中反应③的K>
>
1.0(填“>”、“<”或“=”).(3)在温度相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒压,发生反应②,测得反应达到平衡时的有关数据如下.
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1mol CH3OCH3、1mol H2O | 2mol CH3OH | 1mol CH3OH |
| CH3OH的浓度(mol/L) | c1 | c2 | c3 |
| 反应的能量变化 | 吸收a kJ | 放出b kJ | 放出c kJ |
| 平衡时体积(L) | V1 | V2 | V3 |
| 反应物转化率 | α 1 | α 2 | α 3 |
A、B、C
A、B、C
.(填字母序号)A.a+2c=23.5 B.α1+α2=1 C.V1>V3 D.c1=2c3
(4)上述生产流程中,可以循环使用的物质有
甲醇和水、CO和H2
甲醇和水、CO和H2
.Ⅱ.用二甲醚-空气碱性(KOH)燃料电池作电源电解精炼粗铜(如图),在接通电路一段时间纯Cu质量增加3.2g.

(5)请写出燃料电池中的负极反应式:
CH3OCH3-12e-+16OH-=2CO32-+11H2O
CH3OCH3-12e-+16OH-=2CO32-+11H2O
.(6)燃料电池正极消耗标准状况下空气的体积是
2.8L
2.8L
(空气中O2体积分数以20%计算).二甲醚(CH3OCH3)和甲醇(CH3OH)被称为21世纪的新型燃料,具有清洁、高效等优良的性能.以CH4和H2O为原料制备二甲醚和甲醇的工业流程如下:
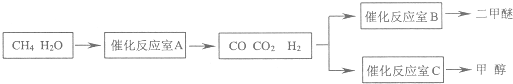
(1)催化反应室B中CO与H2合成二甲醚的化学方程式为
(2)催化反应室A中发生的反应为:
CH4(g)+H2O(g)?CO(g)+3H2(g)…(I)
CO(g)+H2O(g)?CO2(g)+H2(g)…(Ⅱ)
催化反应室C中发生的反应为:
CO(g)+2H2(g)?CH3OH(g)…(Ⅲ)
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)…(Ⅳ)
①已知:原子利用率=
×100%,试求反应(Ⅳ)的原子利用率为
②反应(Ⅳ)的△S
③在压强为5MPa,体积为VL的反应室c中,amol CO与20mol H2在催化剂作用下发生反应(Ⅲ)生成甲醇,CO的’转化率与温度的关系如图.则该反应的△H
(用含字母的代数式表示).
(3)我国某科研所提供一种碱性“直接二甲醚燃料电池”.该燃料电池负极的电极反应式为:
CH3OCH3-12e-+16OH-=2CO2-3+11H2O.有人提出了一种利用氯碱工业产品治理含二氧化硫(体积分数为x)废气的方法如下:
①将含SO2的废气通入电解饱和食盐水所得溶液中,得NaHSO3溶液;
②将电解饱和食盐水所得气体反应后制得盐酸;
③将盐酸加入NaHSO3溶液中得SO2气体回收.
用上述碱性“直接二甲醚燃料电池”电解食盐水来处理标准状况下VL的废气,计算消耗二甲醚的质量
g
g.
查看习题详情和答案>>

(1)催化反应室B中CO与H2合成二甲醚的化学方程式为
2CO+4H2
CH3OCH3+H2O
| ||
| △ |
2CO+4H2
CH3OCH3+H2O
.
| ||
| △ |
(2)催化反应室A中发生的反应为:
CH4(g)+H2O(g)?CO(g)+3H2(g)…(I)
CO(g)+H2O(g)?CO2(g)+H2(g)…(Ⅱ)
催化反应室C中发生的反应为:
CO(g)+2H2(g)?CH3OH(g)…(Ⅲ)
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)…(Ⅳ)
①已知:原子利用率=
| 预期产物的相对分子质量 |
| 全部生成物质的相对分子质量总和 |
64%
64%
.②反应(Ⅳ)的△S
<
<
0(填“>”、“=”或“<”).
③在压强为5MPa,体积为VL的反应室c中,amol CO与20mol H2在催化剂作用下发生反应(Ⅲ)生成甲醇,CO的’转化率与温度的关系如图.则该反应的△H
<
<
0(填“>”、“=”或“<”).300℃时该反应的平衡常数K=| a1V2 |
| 4a2(1-a1) |
| a1V2 |
| 4a2(1-a1) |
(3)我国某科研所提供一种碱性“直接二甲醚燃料电池”.该燃料电池负极的电极反应式为:
CH3OCH3-12e-+16OH-=2CO2-3+11H2O.有人提出了一种利用氯碱工业产品治理含二氧化硫(体积分数为x)废气的方法如下:
①将含SO2的废气通入电解饱和食盐水所得溶液中,得NaHSO3溶液;
②将电解饱和食盐水所得气体反应后制得盐酸;
③将盐酸加入NaHSO3溶液中得SO2气体回收.
用上述碱性“直接二甲醚燃料电池”电解食盐水来处理标准状况下VL的废气,计算消耗二甲醚的质量
| 23V |
| 134.4 |
| 23V |
| 134.4 |
二甲醚和甲醇被称为21世纪的新型燃料,以CH4和H2O为原料制备二甲醚和甲醇的工业流程如图1:
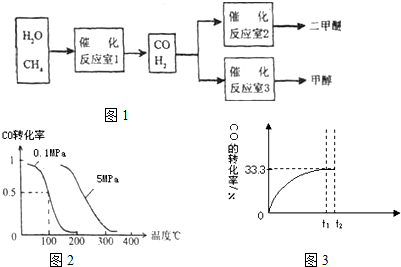
I:(1)在一定条件下,容积为 100L密闭容器中发生反应:CH4(g)+H2O(g)?CO(g)+3H2(g);△H>0
将1.0mol CH4和2.0mol H2O(g)通入该密闭容器 l0min时有0.1mol CO生成,则10min内该反应的平均速率v(H2)
(2)在压强为0.1MPa条件下,容积为V L某密闭容器中a mol CO与 2a mol H2在催化剂作用下反应生成甲醇:CO(g)+2H2(g)?CH3OH(g)平衡时CO的转化率与温度、压强的关系如图2.
①该反应的△H
②100℃时该反应的平衡常数K=
(用含a、V的代数式表示).
③在温度容积不变的情况下,向该密闭容器再增加a mol CO与 2a mol H2,达到新平衡时,CO的转化率
④在某温度下,向一个容积不变的密闭容器中通入2.5mol CO和7.5mol H2反应生成CH3OH(g),达到平衡时CO的转化率为90%,此时容器内的压强为开始时的
II:某温度下,向密闭容器中充入2.0mol CO和1.0mol H2O,发生反应:
CO(g)+H2O(g)?CO2(g)+H2(g).CO的转化率随时间变化关系如图2,回答下列问题:
(1)如果一个可逆反应的平衡常数K值很大,下列说法正确的是
A.该反应的反应物混合后很不稳定
B.该反应一旦发生将在很短的时间内完成
C.该反应达平衡时至少有一种反应物的百分含量很小
D.该反应一定是放热反应 E.该反应使用催化剂意义不大
(2)t2时刻向平衡体系中再通入1.0mol H2O(g),请在原坐标图3中将改变这一条件后CO的转化率的变化结果表示出来.
查看习题详情和答案>>

I:(1)在一定条件下,容积为 100L密闭容器中发生反应:CH4(g)+H2O(g)?CO(g)+3H2(g);△H>0
将1.0mol CH4和2.0mol H2O(g)通入该密闭容器 l0min时有0.1mol CO生成,则10min内该反应的平均速率v(H2)
0.0003mo1?L-1?min-1
0.0003mo1?L-1?min-1
.(2)在压强为0.1MPa条件下,容积为V L某密闭容器中a mol CO与 2a mol H2在催化剂作用下反应生成甲醇:CO(g)+2H2(g)?CH3OH(g)平衡时CO的转化率与温度、压强的关系如图2.
①该反应的△H
<
<
0 (填“<”、“>”或“=”).②100℃时该反应的平衡常数K=
| V2 |
| a2 |
| V2 |
| a2 |
③在温度容积不变的情况下,向该密闭容器再增加a mol CO与 2a mol H2,达到新平衡时,CO的转化率
增大
增大
(填“增大”、“减小”或“不变”).平衡常数不变
不变
(填“增大”、“减小”或“不变”)④在某温度下,向一个容积不变的密闭容器中通入2.5mol CO和7.5mol H2反应生成CH3OH(g),达到平衡时CO的转化率为90%,此时容器内的压强为开始时的
0.55
0.55
倍.II:某温度下,向密闭容器中充入2.0mol CO和1.0mol H2O,发生反应:
CO(g)+H2O(g)?CO2(g)+H2(g).CO的转化率随时间变化关系如图2,回答下列问题:
(1)如果一个可逆反应的平衡常数K值很大,下列说法正确的是
C
C
(填字母).A.该反应的反应物混合后很不稳定
B.该反应一旦发生将在很短的时间内完成
C.该反应达平衡时至少有一种反应物的百分含量很小
D.该反应一定是放热反应 E.该反应使用催化剂意义不大
(2)t2时刻向平衡体系中再通入1.0mol H2O(g),请在原坐标图3中将改变这一条件后CO的转化率的变化结果表示出来.