题目内容
二甲醚(CH3OCH3)和甲醇(CH3OH)被称为21世纪的新型燃料,具有清洁、高效等优良的性能.以CH4和H2O为原料制备二甲醚和甲醇的工业流程如下:
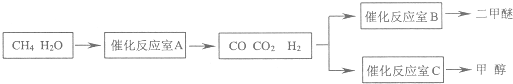
(1)催化反应室B中CO与H2合成二甲醚的化学方程式为
(2)催化反应室A中发生的反应为:
CH4(g)+H2O(g)?CO(g)+3H2(g)…(I)
CO(g)+H2O(g)?CO2(g)+H2(g)…(Ⅱ)
催化反应室C中发生的反应为:
CO(g)+2H2(g)?CH3OH(g)…(Ⅲ)
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)…(Ⅳ)
①已知:原子利用率=
×100%,试求反应(Ⅳ)的原子利用率为
②反应(Ⅳ)的△S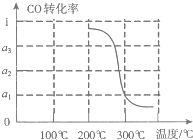
③在压强为5MPa,体积为VL的反应室c中,amol CO与20mol H2在催化剂作用下发生反应(Ⅲ)生成甲醇,CO的’转化率与温度的关系如图.则该反应的△H
(用含字母的代数式表示).
(3)我国某科研所提供一种碱性“直接二甲醚燃料电池”.该燃料电池负极的电极反应式为:
CH3OCH3-12e-+16OH-=2CO2-3+11H2O.有人提出了一种利用氯碱工业产品治理含二氧化硫(体积分数为x)废气的方法如下:
①将含SO2的废气通入电解饱和食盐水所得溶液中,得NaHSO3溶液;
②将电解饱和食盐水所得气体反应后制得盐酸;
③将盐酸加入NaHSO3溶液中得SO2气体回收.
用上述碱性“直接二甲醚燃料电池”电解食盐水来处理标准状况下VL的废气,计算消耗二甲醚的质量
g
g.

(1)催化反应室B中CO与H2合成二甲醚的化学方程式为
2CO+4H2
CH3OCH3+H2O
| ||
| △ |
2CO+4H2
CH3OCH3+H2O
.
| ||
| △ |
(2)催化反应室A中发生的反应为:
CH4(g)+H2O(g)?CO(g)+3H2(g)…(I)
CO(g)+H2O(g)?CO2(g)+H2(g)…(Ⅱ)
催化反应室C中发生的反应为:
CO(g)+2H2(g)?CH3OH(g)…(Ⅲ)
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)…(Ⅳ)
①已知:原子利用率=
| 预期产物的相对分子质量 |
| 全部生成物质的相对分子质量总和 |
64%
64%
.②反应(Ⅳ)的△S
<
<
0(填“>”、“=”或“<”).
③在压强为5MPa,体积为VL的反应室c中,amol CO与20mol H2在催化剂作用下发生反应(Ⅲ)生成甲醇,CO的’转化率与温度的关系如图.则该反应的△H
<
<
0(填“>”、“=”或“<”).300℃时该反应的平衡常数K=| a1V2 |
| 4a2(1-a1) |
| a1V2 |
| 4a2(1-a1) |
(3)我国某科研所提供一种碱性“直接二甲醚燃料电池”.该燃料电池负极的电极反应式为:
CH3OCH3-12e-+16OH-=2CO2-3+11H2O.有人提出了一种利用氯碱工业产品治理含二氧化硫(体积分数为x)废气的方法如下:
①将含SO2的废气通入电解饱和食盐水所得溶液中,得NaHSO3溶液;
②将电解饱和食盐水所得气体反应后制得盐酸;
③将盐酸加入NaHSO3溶液中得SO2气体回收.
用上述碱性“直接二甲醚燃料电池”电解食盐水来处理标准状况下VL的废气,计算消耗二甲醚的质量
| 23V |
| 134.4 |
| 23V |
| 134.4 |
分析:(1)依据流程分析,催化反应室B中CO与H2生成二甲醚和水;
(2)①依据原子利用率的计算方法计算得到;
②反应前后气体体积缩小;
③依据图象分析,随温度升高,一氧化碳转化率减小,平衡逆向进行,逆向是吸热反应,正向是放热反应;依据平衡三段式列式计算平衡浓度,结合平衡常数概念计算得到;
(3)依据化学反应转化关系,热量电池电极饱和氯化钠溶液生成的氢氧化钠吸收二氧化硫,结合电子守恒进行计算;
(2)①依据原子利用率的计算方法计算得到;
②反应前后气体体积缩小;
③依据图象分析,随温度升高,一氧化碳转化率减小,平衡逆向进行,逆向是吸热反应,正向是放热反应;依据平衡三段式列式计算平衡浓度,结合平衡常数概念计算得到;
(3)依据化学反应转化关系,热量电池电极饱和氯化钠溶液生成的氢氧化钠吸收二氧化硫,结合电子守恒进行计算;
解答:解:(1)催化反应室B中CO与H2生成二甲醚和水,反应的化学方程式为:2CO+4H2
CH3OCH3+H2O;
故答案为:2CO+4H2
CH3OCH3+H2O;
(2)①原子利用率=
×100%,反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g)的原子利用率=
×100%=64%;
故答案为:64%;
②反应是气体体积减小的反应,熵变小于0;
故答案为:<;
③依据图象CO的转化率与温度的关系分析,随温度升高,一氧化碳转化率减小,平衡逆向进行,逆向是吸热反应,正向是放热反应,△H<0;依在压强为5MPa,体积为VL的反应室c中,amol CO与20mol H2在催化剂作用下发生反应(Ⅲ)生成甲醇,300°C一氧化碳的转化率为a1列式:
CO(g)+2H2(g)?CH3OH(g)
起始量(mol/L)
0
变化量(mol/L)
×a1 2×
×a1
×a1
平衡量(mol/L)
-
×a1
-2×
×a1
平衡常数K=
=
;
故答案为:
;
(3)CH3OCH3一12e一+16OH一=2CO2-3+11H2O,2H++2e-=H2↑,2NaCl+2H2O
2NaOH+H2↑+Cl2↑,SO2+NaOH=NaHSO3,得到CH3OCH3~12SO2,依据条件计算,设二甲醚质量为X;
CH3OCH3~12SO2
46 12mol
x
mol
x=
g;
故答案为:
g
| ||
| △ |
故答案为:2CO+4H2
| ||
| △ |
(2)①原子利用率=
| 预期产物的相对分子质量 |
| 全部生成物质的相对分子质量总和 |
| 32 |
| 44+6 |
故答案为:64%;
②反应是气体体积减小的反应,熵变小于0;
故答案为:<;
③依据图象CO的转化率与温度的关系分析,随温度升高,一氧化碳转化率减小,平衡逆向进行,逆向是吸热反应,正向是放热反应,△H<0;依在压强为5MPa,体积为VL的反应室c中,amol CO与20mol H2在催化剂作用下发生反应(Ⅲ)生成甲醇,300°C一氧化碳的转化率为a1列式:
CO(g)+2H2(g)?CH3OH(g)
起始量(mol/L)
| a |
| V |
| 20 |
| V |
变化量(mol/L)
| a |
| V |
| a |
| V |
| a |
| V |
平衡量(mol/L)
| a |
| V |
| a |
| V |
| 20 |
| V |
| a |
| V |
| a |
| V |
平衡常数K=
(
| ||||||||
|
| a1V2 |
| 4a2(1-a1) |
故答案为:
| a1V2 |
| 4a2(1-a1) |
(3)CH3OCH3一12e一+16OH一=2CO2-3+11H2O,2H++2e-=H2↑,2NaCl+2H2O
| ||
CH3OCH3~12SO2
46 12mol
x
| V |
| 22,4 |
x=
| 23V |
| 134.4 |
故答案为:
| 23V |
| 134.4 |
点评:本题考查了热化学方程式的书写方法,化学平衡的分析判断,平衡常数计算应用,原电池、电解池原理中的电子守恒计算,题目难度中等.

练习册系列答案
 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案
相关题目

 CO(g)+3H2(g)……(I)、CO(g)+H2O(g)
CO(g)+3H2(g)……(I)、CO(g)+H2O(g) ×100%,试求反应(Ⅳ)的原子利用率为 。
×100%,试求反应(Ⅳ)的原子利用率为 。
 ×100%,试求反应(Ⅳ)的原子利用率为 。
×100%,试求反应(Ⅳ)的原子利用率为 。
 与H2合成二甲醚的化学方程式为 .
与H2合成二甲醚的化学方程式为 . CO(g)+3H2(g)……(I)、CO(g)+H2O(g)
CO(g)+3H2(g)……(I)、CO(g)+H2O(g) ×100%,试求反应(Ⅳ)的原子利用率为 。
×100%,试求反应(Ⅳ)的原子利用率为 。