摘要:请写出电解饱和食盐水的电极反应式: 极: , 极 : .
网址:http://m.1010jiajiao.com/timu3_id_172211[举报]
 工业上电解饱和食盐水可得到多种工业原料,其中氢气和氯气用途非常广泛.
工业上电解饱和食盐水可得到多种工业原料,其中氢气和氯气用途非常广泛.(1)如图所示是离子交换膜(允许钠离子通过,不允许氢氧根与氯离子通过)法电解饱和食盐水示意图.电解过程中,A极发生的是
还原
还原
(填“氧化”或“还原”)反应;B极的电极反应方程式为2Cl--2e=Cl2↑
2Cl--2e=Cl2↑
.若将电极材料换为铁棒,则B极的电极反应为Fe-2e=Fe2+
Fe-2e=Fe2+
.(2)以上反应得到的H2和C12可直接化合制盐酸.有人设想利用原电池原理直接制备盐酸,同时获得电能.若这种设想可行,则通氢气的电极为
负
负
极;通氯气的电极反应式为Cl2+2e=2Cl-
Cl2+2e=2Cl-
.(3)工业制得的浓盐酸往往呈黄色,原因是输送氯气的铁管道被腐蚀所致.请写出有关反应的化学方程式
2Fe+3Cl2=2FeCl3
2Fe+3Cl2=2FeCl3
,这种腐蚀属于化学腐蚀
化学腐蚀
.(4)室温下,将1.000mol?L-1盐酸滴入20.00mL1.000mol?L-1氨水中,当溶液pH=7时,c(Cl-)
=
=
c(NH4+)(填=、>、<);当滴入20.00mL盐酸时,溶液中各离子浓度由大到小的顺序为c(Cl-)>c(NH4+)>c(H+)>c(OH-)
c(Cl-)>c(NH4+)>c(H+)>c(OH-)
.Ⅰ.工业上常用电解饱和食盐水的方法制备氯气,其装置如图1所示,如果在饱和食盐水中滴加酚酞,通电后
Ⅱ.请利用图2装置及试剂组装一套装置,其流程是先制取纯净干燥的Cl2(不收集),后试验干燥的Cl2和潮湿的Cl2有无漂白性.

(1)按气体从左向右流向将各装置依次连接起来(填接口标号):a 接
(2)圆底烧瓶中发生反应的化学方程式是
(3)E装置的作用是
(4)装置
查看习题详情和答案>>
X
X
(填X或Y)极附近溶液变红,写出电解饱和食盐水的化学方程式2NaCl+2H2O
2NaOH+H2↑+Cl2↑
| ||
2NaCl+2H2O
2NaOH+H2↑+Cl2↑
.再用氯气制备漂白粉,请写出漂白粉长期露置在空气中失效的反应的化学方程式
| ||
Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO
Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO
.Ⅱ.请利用图2装置及试剂组装一套装置,其流程是先制取纯净干燥的Cl2(不收集),后试验干燥的Cl2和潮湿的Cl2有无漂白性.

(1)按气体从左向右流向将各装置依次连接起来(填接口标号):a 接
i
i
,j
j
接g
g
,f
f
接e
e
,d
d
接b
b
,c
c
接h
h
.(2)圆底烧瓶中发生反应的化学方程式是
MnO2+4Hl(浓)
MnCl2+Cl2↑+2H2O
| ||
MnO2+4Hl(浓)
MnCl2+Cl2↑+2H2O
.如果将过量二氧化锰与20mL 12mol?L-1的盐酸混合加热,充分反应后生成的氯气明显少于0.06mol.其主要原因为
| ||
反应一段时间后,盐酸浓度变稀,不能和二氧化锰就反应
反应一段时间后,盐酸浓度变稀,不能和二氧化锰就反应
.(3)E装置的作用是
除去多余的氯气,防止污染空气
除去多余的氯气,防止污染空气
,F装置的作用是除去氯气中的氯化氢
除去氯气中的氯化氢
.(4)装置
B
B
(填“B”或“C”)中的有色布条褪色,以上事实说明起漂白作用的物质是次氯酸
次氯酸
.Ⅰ.工业上常用电解饱和食盐水的方法制备氯气,其装置如图1所示,如果在饱和食盐水中滴加酚酞,通电后______ (填X或Y)极附近溶液变红,写出电解饱和食盐水的化学方程式______.再用氯气制备漂白粉,请写出漂白粉长期露置在空气中失效的反应的化学方程式______.
Ⅱ.请利用图2装置及试剂组装一套装置,其流程是先制取纯净干燥的Cl2(不收集),后试验干燥的Cl2和潮湿的Cl2有无漂白性.
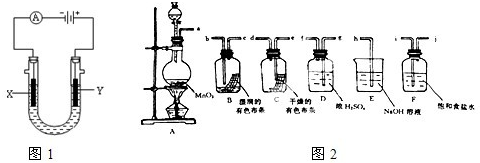
(1)按气体从左向右流向将各装置依次连接起来(填接口标号):a 接______,______接______,______接______,______接______,______接______.
(2)圆底烧瓶中发生反应的化学方程式是______.如果将过量二氧化锰与20mL 12mol?L-1的盐酸混合加热,充分反应后生成的氯气明显少于0.06mol.其主要原因为______.
(3)E装置的作用是______,F装置的作用是______.
(4)装置______(填“B”或“C”)中的有色布条褪色,以上事实说明起漂白作用的物质是______.
查看习题详情和答案>>
Ⅱ.请利用图2装置及试剂组装一套装置,其流程是先制取纯净干燥的Cl2(不收集),后试验干燥的Cl2和潮湿的Cl2有无漂白性.

(1)按气体从左向右流向将各装置依次连接起来(填接口标号):a 接______,______接______,______接______,______接______,______接______.
(2)圆底烧瓶中发生反应的化学方程式是______.如果将过量二氧化锰与20mL 12mol?L-1的盐酸混合加热,充分反应后生成的氯气明显少于0.06mol.其主要原因为______.
(3)E装置的作用是______,F装置的作用是______.
(4)装置______(填“B”或“C”)中的有色布条褪色,以上事实说明起漂白作用的物质是______.
Ⅰ.工业上常用电解饱和食盐水的方法制备氯气,其装置如图1所示,如果在饱和食盐水中滴加酚酞,通电后 (填X或Y)极附近溶液变红,写出电解饱和食盐水的化学方程式 .再用氯气制备漂白粉,请写出漂白粉长期露置在空气中失效的反应的化学方程式 .
Ⅱ.请利用图2装置及试剂组装一套装置,其流程是先制取纯净干燥的Cl2(不收集),后试验干燥的Cl2和潮湿的Cl2有无漂白性.

(1)按气体从左向右流向将各装置依次连接起来(填接口标号):a 接 , 接 , 接 , 接 , 接 .
(2)圆底烧瓶中发生反应的化学方程式是 .如果将过量二氧化锰与20mL 12mol?L-1的盐酸混合加热,充分反应后生成的氯气明显少于0.06mol.其主要原因为 .
(3)E装置的作用是 ,F装置的作用是 .
(4)装置 (填“B”或“C”)中的有色布条褪色,以上事实说明起漂白作用的物质是 . 查看习题详情和答案>>
Ⅱ.请利用图2装置及试剂组装一套装置,其流程是先制取纯净干燥的Cl2(不收集),后试验干燥的Cl2和潮湿的Cl2有无漂白性.

(1)按气体从左向右流向将各装置依次连接起来(填接口标号):a 接 , 接 , 接 , 接 , 接 .
(2)圆底烧瓶中发生反应的化学方程式是 .如果将过量二氧化锰与20mL 12mol?L-1的盐酸混合加热,充分反应后生成的氯气明显少于0.06mol.其主要原因为 .
(3)E装置的作用是 ,F装置的作用是 .
(4)装置 (填“B”或“C”)中的有色布条褪色,以上事实说明起漂白作用的物质是 . 查看习题详情和答案>>
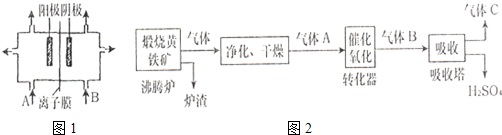
A.(1)工业上电解饱和食盐水中,常将两个极室用离子膜隔开(如图1),其目的是
防止H2与Cl2混合爆炸,防止Cl2与NaOH反应使NaOH不纯
防止H2与Cl2混合爆炸,防止Cl2与NaOH反应使NaOH不纯
,阳极室(A处)加入精制饱和食盐水
精制饱和食盐水
,阴极室(B处)加入去离子水
去离子水
.(2)工业上常以黄铁矿为原料,采用接触法制H2SO4.生产过程如如2:试回答下列问题:
①写出沸腾炉中反应的化学方程式
4FeS2+11O2
2Fe2O3+8SO2
| ||
4FeS2+11O2
2Fe2O3+8SO2
.
| ||
②图中气体净化的主要目的是:
除去杂质,防止催化剂中毒
除去杂质,防止催化剂中毒
.③尾气可用氨水和硫酸处理:处理目的是:
除去SO2并回收利用,防止污染空气
除去SO2并回收利用,防止污染空气
.处理后的产品是:SO2和(NH4)2SO4
SO2和(NH4)2SO4
.④请你写出一种处理后的矿渣的用途.
答:
炉渣中含Fe2O3,经处理后可用作炼铁的原料
炉渣中含Fe2O3,经处理后可用作炼铁的原料
.