题目内容
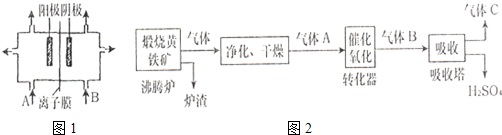
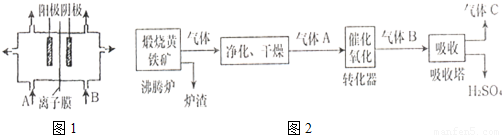
A.(1)工业上电解饱和食盐水中,常将两个极室用离子膜隔开(如图1),其目的是
防止H2与Cl2混合爆炸,防止Cl2与NaOH反应使NaOH不纯
防止H2与Cl2混合爆炸,防止Cl2与NaOH反应使NaOH不纯
,阳极室(A处)加入精制饱和食盐水
精制饱和食盐水
,阴极室(B处)加入去离子水
去离子水
.(2)工业上常以黄铁矿为原料,采用接触法制H2SO4.生产过程如如2:试回答下列问题:
①写出沸腾炉中反应的化学方程式
4FeS2+11O2
2Fe2O3+8SO2
| ||
4FeS2+11O2
2Fe2O3+8SO2
.
| ||
②图中气体净化的主要目的是:
除去杂质,防止催化剂中毒
除去杂质,防止催化剂中毒
.③尾气可用氨水和硫酸处理:处理目的是:
除去SO2并回收利用,防止污染空气
除去SO2并回收利用,防止污染空气
.处理后的产品是:SO2和(NH4)2SO4
SO2和(NH4)2SO4
.④请你写出一种处理后的矿渣的用途.
答:
炉渣中含Fe2O3,经处理后可用作炼铁的原料
炉渣中含Fe2O3,经处理后可用作炼铁的原料
.分析:(1)电解饱和食盐水,阳极发生氧化反应生成氯气,阴极发生还原反应生成氢气,结合氯气的性质解答该题.
(2)工业制硫酸,发生反应为4FeS4+11O2
2F2O3+8SO2,生成二氧化硫气体需除去杂质,防止催化剂中毒,在转化器中进一步发生2SO2+O2
2SO3,在吸收塔中生成硫酸,由于反应可逆,气体C中含有二氧化硫,应进行尾气处理.
(2)工业制硫酸,发生反应为4FeS4+11O2
| ||
| 催化剂 |
| △ |
解答:解:(1)电解饱和食盐水,阳极发生氧化反应生成氯气,阴极发生还原反应生成氢气,为防止H2与Cl2混合爆炸,防止Cl2与NaOH反应使NaOH不纯,常将两个极室用离子膜隔开,电解时阳极室(A处)加入精制饱和食盐水,阴极室(B处)加入去离子水,易维持溶液的离子浓度,
故答案为:防止H2与Cl2混合爆炸,防止Cl2与NaOH反应使NaOH不纯;精制饱和食盐水;去离子水;
(2)①工业制硫酸,发生反应为4FeS2+11O2
2Fe2O3+8SO2,故答案为:4FeS2+11O2
2Fe2O3+8SO2;
②生成二氧化硫气体需除去杂质,防止催化剂中毒,故答案为:除去杂质,防止催化剂中毒;
③由于反应可逆,气体C中含有二氧化硫,防止污染空气,尾气可用氨水和硫酸处理,可生成(NH4)2SO4,
故答案为:除去SO2并回收利用,防止污染空气;SO2和(NH4)2SO4;
④炉渣中含Fe2O3,含铁量较高,经处理后常用作炼铁的原料,
故答案为:炉渣中含Fe2O3,经处理后可用作炼铁的原料.
故答案为:防止H2与Cl2混合爆炸,防止Cl2与NaOH反应使NaOH不纯;精制饱和食盐水;去离子水;
(2)①工业制硫酸,发生反应为4FeS2+11O2
| ||
| ||
②生成二氧化硫气体需除去杂质,防止催化剂中毒,故答案为:除去杂质,防止催化剂中毒;
③由于反应可逆,气体C中含有二氧化硫,防止污染空气,尾气可用氨水和硫酸处理,可生成(NH4)2SO4,
故答案为:除去SO2并回收利用,防止污染空气;SO2和(NH4)2SO4;
④炉渣中含Fe2O3,含铁量较高,经处理后常用作炼铁的原料,
故答案为:炉渣中含Fe2O3,经处理后可用作炼铁的原料.
点评:本题综合考查电解原理和工业制备硫酸,题目难度不大,注意把握电解原理和工业制备硫酸的制备流程,注意相关知识的积累.

练习册系列答案
相关题目