摘要: (1)写出A.B.C元素名称:A: 氧 .B: 镁 .C: 钠 , (2)B离子的结构示意图为 , (3)请请用电子式表示化合物AC的形成过程: .
网址:http://m.1010jiajiao.com/timu3_id_172121[举报]
 A、B、C是由H、O、Na三种元素中的两种或三种元素组成的三种化合物,其中化合物A为淡黄色固体.甲、乙、丙是三种单质,分别由上述元素组成.上述单质和化合物之间存在如图反应关系:
A、B、C是由H、O、Na三种元素中的两种或三种元素组成的三种化合物,其中化合物A为淡黄色固体.甲、乙、丙是三种单质,分别由上述元素组成.上述单质和化合物之间存在如图反应关系:据此推断
(1)化合物A、B、C分别是(用化学式表示):A
Na2O2
Na2O2
;BH2O
H2O
;CNaOH
NaOH
.(2)甲、乙、丙分别是(写名称):甲
钠
钠
;乙氧气
氧气
;丙氢气
氢气
.(3)写出化合物A与化合物B反应,生成单质乙和化合物C的反应方程式:
2Na2O2+2H2O═4NaOH+O2↑
2Na2O2+2H2O═4NaOH+O2↑
.A、B、C、D、E是短周期元素,周期表中A与B、B与C相邻,且C与E同主族;A与E的最外层电子数之比2:3,B的最外层电子数比C的最外层电子数少1个;常见化合物D2C2与水反应生成C的单质,且溶液使酚酞试液变红.
(1)E的元素名称是
(2)A、B、C的氢化物稳定性由弱到强的顺序为(用分子式表示)
(3)写出D2C2的电子式
 .用电子式表示只含D、E两种元素的化合物的形成过程
.用电子式表示只含D、E两种元素的化合物的形成过程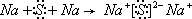
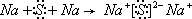
(4)写出D2C2与H2O反应的离子方程式
查看习题详情和答案>>
(1)E的元素名称是
硫
硫
.该元素在周期表中的位置为第三周期VIA族
第三周期VIA族
(2)A、B、C的氢化物稳定性由弱到强的顺序为(用分子式表示)
CH4<NH3<H2O
CH4<NH3<H2O
;B的氢化物和B的最高价氧化物的水化物反应生成Z,则Z中所含化学键的类型为离子键、极性键
离子键、极性键
(3)写出D2C2的电子式


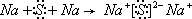
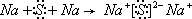
(4)写出D2C2与H2O反应的离子方程式
2Na2O2+2H2O=4Na++4OH-+O2↑
2Na2O2+2H2O=4Na++4OH-+O2↑
.A、B、C、D是四种短周期元素,它们的原子序数依次增大,其中,A、C及B、D分别是同主族元素;A元素的原子半径是所有主族元素中原子半径最小的;B、D两元素的原子核中质子数之和是A、C两元素原子核中质子数之和的2倍;四种元素所形成的单质中A、B单质是气体,C、D单质是固体.
(1)B、C两元素的名称为:
(2)用电子式表示C2D的形成过程:
 .
.
(3)由B、C两元素所形成的原子个数比为1:1的化合物属于
(4)实验室常用A、B两元素所形成的原子个数为1:1的化合物来制备一种常见气体,其化学方程式为
查看习题详情和答案>>
(1)B、C两元素的名称为:
氧、钠
氧、钠
;(2)用电子式表示C2D的形成过程:


(3)由B、C两元素所形成的原子个数比为1:1的化合物属于
离子
离子
(填“离子”或“共价”)化合物,存在的化学键的种类有离子键、非极性键
离子键、非极性键
,写出它与水反应的离子方程式2Na2O2+2H2O=4Na++4OH-+O2↑
2Na2O2+2H2O=4Na++4OH-+O2↑
.(4)实验室常用A、B两元素所形成的原子个数为1:1的化合物来制备一种常见气体,其化学方程式为
2H2O2
2H2O+O2↑
| ||
2H2O2
2H2O+O2↑
.此实验中常加入一种黑色粉未物质,其作用是
| ||
催化剂
催化剂
.A、B、C是三种短周期元素,它们的原子序数依次增大.已知A是地壳中含量最多的元素;B元素原子的最外层只有一个电子;C元素的单质在常温下是黄绿色的气体.
①写出A、B的元素名称:A
②写出C元素最高价氧化物对应水化物的化学式
查看习题详情和答案>>
①写出A、B的元素名称:A
氧
氧
,B钠
钠
②写出C元素最高价氧化物对应水化物的化学式
HClO4
HClO4
. a、b、c、d、e是含有一种相同元素的五种物质,可发生如图转化:其中:a是单质;b是气体;c、d是氧化物;e是最高价氧化物对应的水化物.
a、b、c、d、e是含有一种相同元素的五种物质,可发生如图转化:其中:a是单质;b是气体;c、d是氧化物;e是最高价氧化物对应的水化物.(1)如果a是一种淡黄色粉末固体,试推断这五种物质(用名称表示):
a
硫
硫
;b硫化氢
硫化氢
;c二氧化硫
二氧化硫
;d三氧化硫
三氧化硫
;e硫酸
硫酸
.并写出由c生成d的化学方程式
2SO2+O2
2SO3
| 催化剂 |
| △ |
2SO2+O2
2SO3
| 催化剂 |
| △ |
(2)如果a为单质且是一种常见气体,试推断这五种物质(用化学式表示):
a
N2
N2
;bNH3
NH3
;cNO
NO
;dNO2
NO2
;eHNO3
HNO3
.并写出由d生成e的化学方程式
3NO2+H2O=2HNO3+NO
3NO2+H2O=2HNO3+NO
.