摘要:7 有关下列反应产物的叙述.错误的是 A 在Cl2中点燃铁丝.有FeCl2生成 B 将C12通入水中.有HCl生成 C 将Cl2通人KBr溶液中.有Br2生成 D 将Cl2通入NaOH溶液中.有NaClO生成 8 在一定条件下.反应A2(g)+B2(g)2AB(g).达到反应限度的标志是 A 容器内气体的总压强不随时间的变化而变化 B 单位时间内有nmolA2生成.同时就有nmolB2生成 C 单位时间内有nmolA2生成.同时就有nmolAB生成 D 单位时间内有nmolB2发生反应.同时就有2nmolAB分解 9 1999年诺贝尔化学奖获得者艾哈迈德·泽维尔.开创了“飞秒化学 的新领域.使运用激光光谱技术观测化学反应时分子中的原子的运动成为可能.你认为该技术不能观察到的是 A 化学变化中反应物分子的分解 B 反应中原子的运动 C 化学变化中生成物分子的形成 D 原子核的内部结构 10 在下列描述中一定有新物质生成的是 A 有热量吸收或有热量放出的物质变化 B 碳单质石墨转化为碳单质金刚石 C 有化学键断裂的物质变化 D 将含钾元素的物质在酒精灯火焰上燃烧时.火焰显紫色
网址:http://m.1010jiajiao.com/timu3_id_172030[举报]
.海水中含有丰富的化学元素,下面是某化工厂从海水中提取NaCl、Mg(以MgCl2形式存在)和Br2(以NaBr的形式存在)及综合利用的生产流程简图:
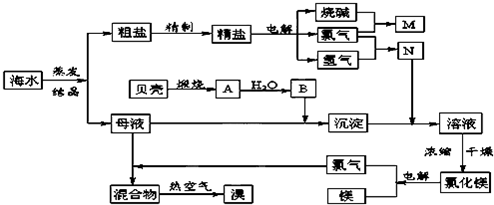
请回答:
(1)在粗盐中含有Ca2+、Mg2+、SO42-等杂质,精制时所用的试剂为:
A.盐酸 B.氯化钡溶液 C.氢氧化钠溶液 D.碳酸钠溶液.
则加入试剂的顺序是(填编号)
(2)Mg(OH)2中加入盐酸后,要获得MgCl2?6H2O晶体,需要进行的实验操作依次
A.蒸馏 B.灼烧 C.过滤 D.蒸发 E.冷却结晶
(3)目前工业上主要采用离子交换膜法电解饱和食盐水,下列关于离子交换膜电解槽的叙述错误的是
A.精制饱和食盐水进入阳极室 B.纯水(加少量NaOH)进入阴极室
C.阴极产物为氢氧化钠和氢气 D.电解槽的阳极用金属铁网制成
(4)写出电解饱和NaCl溶液的电极反应方程式:
(5)此工业煅烧贝壳得到氧化钙.石灰石和贝壳的主要成份相同,事实上,石灰石在许多化学工业生产都发挥了极大的作用,请写出一条化工生产中碳酸钙参与的化学反应方程式(此工业涉及的方程式除外)
(6)利用MgCl2?6H2O可制得无水氯化镁,应采取的措施是
(7)用热空气吹出的溴蒸气可以用亚硫酸钠溶液吸收,写出反应的化学方程式:
查看习题详情和答案>>

请回答:
(1)在粗盐中含有Ca2+、Mg2+、SO42-等杂质,精制时所用的试剂为:
A.盐酸 B.氯化钡溶液 C.氢氧化钠溶液 D.碳酸钠溶液.
则加入试剂的顺序是(填编号)
C B D A或B C D A
C B D A或B C D A
.(2)Mg(OH)2中加入盐酸后,要获得MgCl2?6H2O晶体,需要进行的实验操作依次
DEC
DEC
.A.蒸馏 B.灼烧 C.过滤 D.蒸发 E.冷却结晶
(3)目前工业上主要采用离子交换膜法电解饱和食盐水,下列关于离子交换膜电解槽的叙述错误的是
D
D
.A.精制饱和食盐水进入阳极室 B.纯水(加少量NaOH)进入阴极室
C.阴极产物为氢氧化钠和氢气 D.电解槽的阳极用金属铁网制成
(4)写出电解饱和NaCl溶液的电极反应方程式:
2Cl--2e-═Cl2↑:2H++2e-═H2↑;
2Cl--2e-═Cl2↑:2H++2e-═H2↑;
.(5)此工业煅烧贝壳得到氧化钙.石灰石和贝壳的主要成份相同,事实上,石灰石在许多化学工业生产都发挥了极大的作用,请写出一条化工生产中碳酸钙参与的化学反应方程式(此工业涉及的方程式除外)
CaCO3+SiO2
CaSiO3+CO2
| ||
CaCO3+SiO2
CaSiO3+CO2
.
| ||
(6)利用MgCl2?6H2O可制得无水氯化镁,应采取的措施是
要在HCl气流中脱水,
要在HCl气流中脱水,
.(7)用热空气吹出的溴蒸气可以用亚硫酸钠溶液吸收,写出反应的化学方程式:
2Na2SO3+Br2+H2O=2Na2SO4+2HBr
2Na2SO3+Br2+H2O=2Na2SO4+2HBr
.