摘要:已知化学反应5NH4NO32HNO3+4N2 +9H2O.则发生氧化反应与发生还原反应的氮原子个数之比是 ( ) A.1:3 B.5:3 C.5:8 D.5:4
网址:http://m.1010jiajiao.com/timu3_id_171018[举报]
运用化学反应原理研究氮、硫、氯、碘等单质及其化合物的反应有重要意义.
Ⅰ.硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g)?2SO3(g),混合体系中SO3的百分含量和温度的关系如图1所示(曲线上任何一点都表示平衡状态).
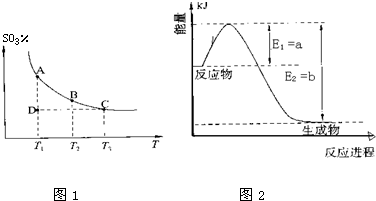
根据图示回答下列问题:
①2SO2(g)+O2(g)?2SO3(g)的△H
②若在恒温、恒容条件下向上述平衡体系中通He,V正
③若在恒温、恒压条件下向上述平衡体系中通入氦气,V正
Ⅱ.氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.
①如图2是一定的温度和压强下是N2和H2反应生成1molNH3过程中能量变化示意图,请写出工业合成氨的热化学反应方程式:
②工业合成氨的反应为N2(g)+3H2(g)
2NH3(g).在一定温度下,将一定量的N2和H2通入到体积为1L的密闭容器中达到平衡后.改变下列条件,能使平衡向正反应方向移动且平衡常数不变的是
A、增大压强 B、增大反应物的浓度 C、使用催化剂 D、降低温度
③工业合成氨的反应为N2(g)+3H2(g)
2NH3(g).设在容积为2.0L的密闭容器中充入0.60mol N2(g)和1.60mol H2(g).反应在一定条件下达到平衡时,NH3的体积分数为
.计算:该条件下N2(g)+3H2(g)
2NH3(g)的平衡常数为
④已知化学反应:N2(g)+3H2(g)?2NH3(g);其化学平衡常数K与温度T的关系如下表:
400℃时,在2L的密闭容器中2NH3(g)?N2(g)+3H2(g) 的化学平衡常数K的值为
查看习题详情和答案>>
Ⅰ.硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g)?2SO3(g),混合体系中SO3的百分含量和温度的关系如图1所示(曲线上任何一点都表示平衡状态).

根据图示回答下列问题:
①2SO2(g)+O2(g)?2SO3(g)的△H
<
<
0.若温度为T1、T2,反应的平衡常数分别为K1、K2,则K1>
>
K2;若反应进行到状态D时,v正>
>
v逆(填“>”、“<”或“=”).②若在恒温、恒容条件下向上述平衡体系中通He,V正
不变
不变
(填“增大”、“减小”或“不变”);平衡不
不
移动(填“向左”、“向右”或“不”).③若在恒温、恒压条件下向上述平衡体系中通入氦气,V正
减小
减小
,V逆减小
减小
;平衡向左
向左
移动.Ⅱ.氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.
①如图2是一定的温度和压强下是N2和H2反应生成1molNH3过程中能量变化示意图,请写出工业合成氨的热化学反应方程式:
N2(g)+3H2(g)═2NH3(g)△H=-2(b-a)kJ?mol-1
N2(g)+3H2(g)═2NH3(g)△H=-2(b-a)kJ?mol-1
(△H的数值用含字母a、b的代数式表示).②工业合成氨的反应为N2(g)+3H2(g)
| ||
| 高温 |
AB
AB
.A、增大压强 B、增大反应物的浓度 C、使用催化剂 D、降低温度
③工业合成氨的反应为N2(g)+3H2(g)
| ||
| 高温 |
| 4 |
| 7 |
| ||
| 高温 |
200
200
;N2的平衡转化率为66.7%
66.7%
.④已知化学反应:N2(g)+3H2(g)?2NH3(g);其化学平衡常数K与温度T的关系如下表:
| T/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
2
2
.当测得NH3和N2、H2的物质的量分别为12mol和8mol、4mol时,则该反应的v正(N2)大于
大于
v逆(N2)(填“大于”、“小于”或“等于”)已知化学反应A2(g)+B2(g)=2AB(g)的能量变化如图所示,下列叙述正确的是( )


| A、每生成2分子AB吸收bkJ热量 | B、该反应热△H=(b-a)kJ?mol-1 | C、反应物的总能量低于生成物的总能量 | D、断裂1molA-A和1molB-B键,放出akJ能量 |
 二氧化硫和氮的氧化物是大气的主要污染物,防止和治理环境污染是当前环保工作的重要研究内容之一.
二氧化硫和氮的氧化物是大气的主要污染物,防止和治理环境污染是当前环保工作的重要研究内容之一.(1)一定条件下,2SO3(g)?2SO2(g)+O2(g),向1.6LA(A容器可以自由滑动)和2LB密闭容器中各通入2mol SO3(g),在相同温度和有催化剂的条件下两容器各自达到平衡,测得A容器为1.8L,则A容器中SO3的转化率为
(2)打开K一段时间再达平衡时,A容器的体积为
(3)用CH4催化还原NOx为N2可以消除氮氧化物的污染.试写出总反应方程式:
(4)CO在催化条件下也可以消除NO的污染.要计算该反应消耗1molCO的焓变△H.请依据盖斯定律设计:利用两个已知化学反应的焓变(焓变分别设为△H1、△H2)计算△H的过程
已知化学反应①:Fe(s)+CO2(g)=FeO(s)+CO(g),其平衡常数为K1;化学反应②:Fe(s)+H2O(g)=FeO(s)+H2(g),其平衡常数K2.在温度973K和1173K情况下,K1、K2的值分别如下:
(1)通常表格中的数值可以推断:反应①是
(2)现有反应③:CO2(g)+H2(g)=CO(g)+H2O(g),请你写出该反应的平衡常数K3的数学表达式:K3=
.
(3)根据反应①与②可推导出K1、K2与K3之间的关系式
.据此关系式及上表数据,也能推断出反应③是
A.缩小反应容器容积 B.扩大反应容器容积 C.降低温度 D.升高温度
E.使用合适的催化剂 F.设法减少CO的浓度.
查看习题详情和答案>>
| 温度 | K1 | K2 |
| 973K | 1.47 | 2.38 |
| 1173K | 2.15 | 1.67 |
吸热
吸热
(填“吸热”或“放热”)反应.(2)现有反应③:CO2(g)+H2(g)=CO(g)+H2O(g),请你写出该反应的平衡常数K3的数学表达式:K3=
| [CO][H2O] |
| [H2][CO2] |
| [CO][H2O] |
| [H2][CO2] |
(3)根据反应①与②可推导出K1、K2与K3之间的关系式
| K1 |
| K2 |
| K1 |
| K2 |
吸热
吸热
(填“吸热”或“放热”)反应,要使反应③在一定条件下建立的平衡向正反应方向移动,可采取的措施有DF
DF
(填写序号).A.缩小反应容器容积 B.扩大反应容器容积 C.降低温度 D.升高温度
E.使用合适的催化剂 F.设法减少CO的浓度.