网址:http://m.1010jiajiao.com/timu3_id_170396[举报]
在自来水消毒和工业上砂糖、油脂的漂白与杀菌过程中,亚氯酸钠(NaClO2)发挥着重要的作用。下图是生产亚氯酸钠的工艺流程图:
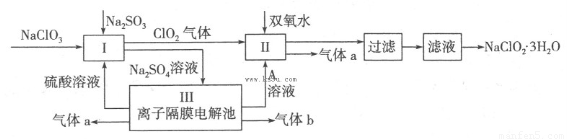
已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2·3H2O;
??? ②常温下,Ksp(FeS)=6.3×10-18;Ksp(CuS)=6.3×10-28;Ksp(PbS)=2.4 ×10-28
(1)反应I中发生反应的离子方程式为?????? 。
(2)从滤液中得到NaClO2·3H2O晶体的所需操作依次是?????? (填写序号)。
a.蒸馏 ?? b.蒸发浓缩?? c.过滤 ?? d.冷却结晶??? e.灼烧
(3)印染工业常用亚氯酸钠(NaClO2)漂白织物,漂白织物时真正起作用的是HClO2。下表是25℃时HClO2及几种常见弱酸的电离平衡常数:
弱酸 | HClO2 | HF | H2CO3 | H2S |
Ka/mol·L-1 | 1×10-2 | 6.3×10-4 | K1=4.30×10-7 K2=5.60×10-11 | K1=9.1×10-8 K2=l.1×10-12 |
①常温下,物质的量浓度相等的NaClO2、NaF、NaHCO3、Na2S四种溶液的pH由大到小的顺序为??????? (用化学式表示);体积相等,物质的量浓度相同的NaF、NaClO2两溶液中所含阴阳离子总数的大小关系为:?????????????? (填“前者大”“相等”或“后者大”)。
②Na2S是常用的沉淀剂。某工业污水中含有等浓度的Cu2+、Fe2+、Pb2+离子,滴加Na2S溶液后首先析出的沉淀是???????? ;常温下,当最后一种离子沉淀完全时(该离子浓度为10-5mol·L-1)此时体系中的S2-的浓度为?????????? 。
(4)Ⅲ装置中生成气体a的电极反应式?????????? ,若生成气体a的体积为1.12L(标准状况),则转移电子的物质的量为??? 。
查看习题详情和答案>>
在自来水消毒和工业上砂糖、油脂的漂白与杀菌过程中,亚氯酸钠(NaClO2)发挥着重要的作用。下图是生产亚氯酸钠的工艺流程图: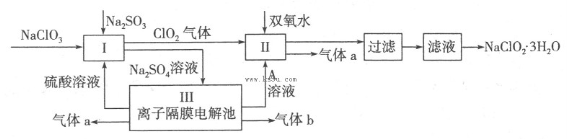
已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出
NaClO2·3H2O;
②常温下,Ksp(FeS)=6.3×10-18;Ksp(CuS)=6.3×10-28;Ksp(PbS)=2.4 ×10-28
(1)反应I中发生反应的离子方程式为 。
(2)从滤液中得到NaClO2·3H2O晶体的所需操作依次是 (填写序号)。
a.蒸馏 b.蒸发浓缩 c.过滤 d.冷却结晶 e.灼烧
(3)印染工业常用亚氯酸钠(NaClO2)漂白织物,漂白织物时真正起作用的是HClO2。下表是25℃时HClO2及几种常见弱酸的电离平衡常数:
| 弱酸 | HClO2 | HF | H2CO3 | H2S |
| Ka/mol·L-1 | 1×10-2 | 6.3×10-4 | K1=4.30×10-7 K2=5.60×10-11 | K1=9.1×10-8 K2=l.1×10-12 |
②Na2S是常用的沉淀剂。某工业污水中含有等浓度的Cu2+、Fe2+、Pb2+离子,滴加Na2S溶液后首先析出的沉淀是 ;常温下,当最后一种离子沉淀完全时(该离子浓度为10-5mol·L-1)此时体系中的S2-的浓度为 。
(4)Ⅲ装置中生成气体a的电极反应式 ,若生成气体a的体积为1.12L(标准状况),则转移电子的物质的量为 。 查看习题详情和答案>>
在自来水消毒和工业上砂糖、油脂的漂白与杀菌过程中,亚氯酸钠(NaClO2)发挥着重要的作用。下图是生产亚氯酸钠的工艺流程图:
已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2·3H2O;
②常温下,Ksp(FeS)=6.3×10-18;Ksp(CuS)=6.3×10-28;Ksp(PbS)=2.4 ×10-28
(1)反应I中发生反应的离子方程式为 。
(2)从滤液中得到NaClO2·3H2O晶体的所需操作依次是 (填写序号)。
a.蒸馏 b.蒸发浓缩 c.过滤 d.冷却结晶 e.灼烧
(3)印染工业常用亚氯酸钠(NaClO2)漂白织物,漂白织物时真正起作用的是HClO2。下表是25℃时HClO2及几种常见弱酸的电离平衡常数:
| 弱酸 | HClO2 | HF | H2CO3 | H2S |
| Ka/mol·L-1 | 1×10-2 | 6.3×10-4 | K1=4.30×10-7 K2=5.60×10-11 | K1=9.1×10-8 K2=l.1×10-12 |
①常温下,物质的量浓度相等的NaClO2、NaF、NaHCO3、Na2S四种溶液的pH由大到小的顺序为 (用化学式表示);体积相等,物质的量浓度相同的NaF、NaClO2两溶液中所含阴阳离子总数的大小关系为: (填“前者大”“相等”或“后者大”)。
②Na2S是常用的沉淀剂。某工业污水中含有等浓度的Cu2+、Fe2+、Pb2+离子,滴加Na2S溶液后首先析出的沉淀是 ;常温下,当最后一种离子沉淀完全时(该离子浓度为10-5mol·L-1)此时体系中的S2-的浓度为 。
(4)Ⅲ装置中生成气体a的电极反应式 ,若生成气体a的体积为1.12L(标准状况),则转移电子的物质的量为 。 查看习题详情和答案>>

已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出
NaClO2·3H2O;
②常温下,Ksp(FeS)=6.3×10-18;Ksp(CuS)=6.3×10-28;Ksp(PbS)=2.4 ×10-28
(1)反应I中发生反应的离子方程式为 。
(2)从滤液中得到NaClO2·3H2O晶体的所需操作依次是 (填写序号)。
a.蒸馏 b.蒸发浓缩 c.过滤 d.冷却结晶 e.灼烧
(3)印染工业常用亚氯酸钠(NaClO2)漂白织物,漂白织物时真正起作用的是HClO2。下表是25℃时HClO2及几种常见弱酸的电离平衡常数:
| 弱酸 | HClO2 | HF | H2CO3 | H2S |
| Ka/mol·L-1 | 1×10-2 | 6.3×10-4 | K1=4.30×10-7 K2=5.60×10-11 | K1=9.1×10-8 K2=l.1×10-12 |
②Na2S是常用的沉淀剂。某工业污水中含有等浓度的Cu2+、Fe2+、Pb2+离子,滴加Na2S溶液后首先析出的沉淀是 ;常温下,当最后一种离子沉淀完全时(该离子浓度为10-5mol·L-1)此时体系中的S2-的浓度为 。
(4)Ⅲ装置中生成气体a的电极反应式 ,若生成气体a的体积为1.12L(标准状况),则转移电子的物质的量为 。