摘要:8mol/L×0.025L 则:2 mol:22.4L=:---------- 解得: =3.3 L------------
网址:http://m.1010jiajiao.com/timu3_id_170279[举报]
标况下充满HCl的烧瓶做完喷泉实验后得到稀盐酸,用标准碳酸钠溶液滴定这种盐酸测定它的准确浓度,请你回答下列问题:
(1)用标准碳酸钠溶液滴定这种盐酸时,碳酸钠溶液应装在________式滴定管中,若用甲基橙作指示剂,达到滴定终点时,溶液从________色变成________色.
(2)现配制三种浓度的标准碳酸钠溶液,你认为最合适的是下列第________种.
①2.500 mol/L
②0.25 mol/L
③0.025 mol/L
(3)若采用上述合适的标准碳酸钠溶液滴定,用c(Na2CO3)表示,滴定时实验数据列表如下:
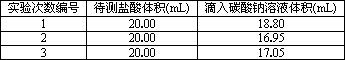
求这种待测稀盐酸的物质的量浓度(用题中所给数据列出计算式即可).
c(HCl)=________.
(4)若盛装Na2CO3溶液的滴定管在滴定前未用标准液润洗,则最后所测盐酸浓度________,若滴定完毕后读数时俯视,则实验误差为________(以上两空填“偏高”、“偏低”或“无影响”)
实验室需要200mL1.0mol/L的NaOH溶液用于测定某盐酸样品的浓度.
(1)下列仪器中,配制NaOH溶液时必须用到的是(填写序号)
①100mL量筒 ②烧杯 ③100mL容量瓶 ④250mL容量瓶 ⑤天平 ⑥胶头滴管 ⑦玻璃棒
(2)需要称量NaOH固体的质量是
(3)出现下列操作时,将使所配制的溶液浓度偏低的是
A.将烧杯内的NaOH溶液向容量瓶内转移时,部分溶液溅出瓶外
B.将烧杯内的NaOH溶液转移至容量瓶后,未洗涤烧杯和玻璃棒
C.定容时仰视观察容量瓶刻度线和凹液面的最低点
(4)量取25mL待测盐酸,当加入20mL 1.0mol/L的NaOH溶液时,恰好完全中和,则盐酸的物质的量浓度是
查看习题详情和答案>>
(1)下列仪器中,配制NaOH溶液时必须用到的是(填写序号)
②④⑤⑥⑦
②④⑤⑥⑦
.①100mL量筒 ②烧杯 ③100mL容量瓶 ④250mL容量瓶 ⑤天平 ⑥胶头滴管 ⑦玻璃棒
(2)需要称量NaOH固体的质量是
10.0g
10.0g
.(3)出现下列操作时,将使所配制的溶液浓度偏低的是
AB
AB
.A.将烧杯内的NaOH溶液向容量瓶内转移时,部分溶液溅出瓶外
B.将烧杯内的NaOH溶液转移至容量瓶后,未洗涤烧杯和玻璃棒
C.定容时仰视观察容量瓶刻度线和凹液面的最低点
(4)量取25mL待测盐酸,当加入20mL 1.0mol/L的NaOH溶液时,恰好完全中和,则盐酸的物质的量浓度是
0.8mol/L
0.8mol/L
.一定温度下,将3molA气体和1molB气体通过一密闭容器中,发生如下反应:3A(g)+B(g)?xC(g).
请填写下列空白:
(1)若容器体积固定为2L,反应1min时测得剩余1.8molA,C的浓度为0.4mol/L.
①1min内,B的平均反应速率为
②若反应经2min达到平衡,平衡时C的浓度
③平衡混合物中,C的体积分数为20%,则A的转化率是
④恒温恒容下,改变起始物质加入的量,欲使反应达到平衡时C的物质的量分数与原平衡相等,若起始加入的A、B、C三种物质的物质的量分别为n1、n2、n3,则n1与n3、n2与n3之间应满足的关系为:
(2)若维持恒温恒压下:
①达到平衡时C的体积分数
②改变起始物质加入的量,欲使反应达到平衡时C的物质的量是原平衡的2倍,则应加入
查看习题详情和答案>>
请填写下列空白:
(1)若容器体积固定为2L,反应1min时测得剩余1.8molA,C的浓度为0.4mol/L.
①1min内,B的平均反应速率为
0.2mol/(L?min)
0.2mol/(L?min)
;x的值为2
2
;②若反应经2min达到平衡,平衡时C的浓度
小于
小于
0.8mol/L(填“大于”、“等于”或“小于”);③平衡混合物中,C的体积分数为20%,则A的转化率是
33.3%
33.3%
;④恒温恒容下,改变起始物质加入的量,欲使反应达到平衡时C的物质的量分数与原平衡相等,若起始加入的A、B、C三种物质的物质的量分别为n1、n2、n3,则n1与n3、n2与n3之间应满足的关系为:
n1+
n3=3,n2+
n3=1
| 3 |
| 2 |
| 1 |
| 2 |
n1+
n3=3,n2+
n3=1
.| 3 |
| 2 |
| 1 |
| 2 |
(2)若维持恒温恒压下:
①达到平衡时C的体积分数
大于
大于
20%,(填“大于”、“等于”或“小于”);②改变起始物质加入的量,欲使反应达到平衡时C的物质的量是原平衡的2倍,则应加入
6
6
mol A气体和2
2
mol B气体.