网址:http://m.1010jiajiao.com/timu3_id_169990[举报]
已知:A、B、C、D、E、F六种元素,原子序数依次增大。A原子核外有两种形状的电子云,两种形状的电子云轨道上电子数相等;B是短周期中原子半径最大的元素;C元素3p能级半充满;E是所在周期电负性最大的元素;F是第四周期未成对电子最多的元素。试回答下列有关的问题:
(1)写出F元素的电子排布式_______。
(2)已知A元素的一种氢化物分子中含四个原子,则在该化合物的分子中A原子的杂化轨道类型为______。
(3)已知C、E两种元素形成的化合物通常有CE3、CE5两种。这两种化合物中一种为非极性分子,一种为极性分子,属于极性分子的化合物的分子空间构型是______。
(4)B、C、D、E的第一电离能由大到小的顺序是______ (写元素符号)。四种元素最高价氧化物的水化物形成的溶液,物质的量浓度相同时,pH由大到小的顺序是______(写化学式)。
(5)由B、E两元素形成的化合物组成的晶体中,阴、阳离子都有球型对称结构,它们都可以看作刚性圆球,并彼此“相切”。如下图所示为B、E形成化合物的晶胞结构图以及晶胞的剖面图:

晶胞中距离一个Na+最近的Na+有____________个。若晶体密度为ρ g·cm-3,阿伏加德罗常的值用NA表示,则Cl-的离子半径_____cm(用含NA与ρ式子表达)。
查看习题详情和答案>>
(1)写出F元素的电子排布式_______。
(2)已知A元素的一种氢化物分子中含四个原子,则在该化合物的分子中A原子的杂化轨道类型为______。
(3)已知C、E两种元素形成的化合物通常有CE3、CE5两种。这两种化合物中一种为非极性分子,一种为极性分子,属于极性分子的化合物的分子空间构型是______。
(4)B、C、D、E的第一电离能由大到小的顺序是______ (写元素符号)。四种元素最高价氧化物的水化物形成的溶液,物质的量浓度相同时,pH由大到小的顺序是______(写化学式)。
(5)由B、E两元素形成的化合物组成的晶体中,阴、阳离子都有球型对称结构,它们都可以看作刚性圆球,并彼此“相切”。如下图所示为B、E形成化合物的晶胞结构图以及晶胞的剖面图:

晶胞中距离一个Na+最近的Na+有____________个。若晶体密度为ρ g·cm-3,阿伏加德罗常的值用NA表示,则Cl-的离子半径_____cm(用含NA与ρ式子表达)。
(1)在一定体积的恒容密闭容器中,进行如下化学反应: N2(g)+3H2(g)
 2NH3(g) 其化学平衡常数K与温度t的关系如下表,根据下表完成下列问题
2NH3(g) 其化学平衡常数K与温度t的关系如下表,根据下表完成下列问题 
②判断该反应达到化学平衡状态的依据是____________(填序号)。
A.2v(H2)(正)=3v(NH3)(逆)
B.v(N2)(正)=3v(H2)(逆)
C.容器内压强保持不变
D.混合气体的密度保持不变
(2)盐酸肼(N2H6Cl2)是一种重要的化工原料,属于离子化合物,易溶于水,溶液呈酸性,水解原理与NH4Cl类似。
①写出盐酸肼第一步水解反应的离子方程式____________________。
②盐酸肼水溶液中离子浓度的排列顺序正确的是______________(填序号)。
A.c(Cl-)>c(N2H62+)>c(H+)>c(OH-);
B.c(Cl-)>c([N2H5·H2O+])> c(H+)>c(OH-);
C.c(N2H62+)+ c([N2H5·H2O+])+c(H+)= c(Cl-)+c(OH-);
D.c(N2H62+)> c(Cl-)>c(H+)>c(OH-);
Ⅱ.水体中重金属铅的污染问题备受关注。查资料得知Pb4+具有很强的氧化性。水中铅的存在形态主要有Pb2+、Pb(OH)+、Pb(OH)2(在水中溶解度小)、Pb(OH)3-、Pb(OH)42-,各形态的物质的量的分数α随溶液pH变化的关系如下图所示:
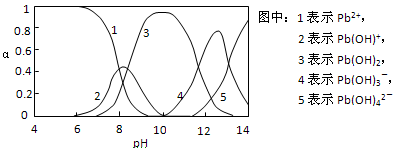
(2)向Pb(NO3)2溶液滴加盐酸,溶液中c(Pb2+)/c(NO3-)没有变大,反而变小并有沉淀生成,则生成的沉淀可能为___________。
(3)向Pb(NO3)2溶液中滴加NaOH溶液,溶液也变浑浊,在pH约为________时生成沉淀最多,继续滴加NaOH溶液,混合体系又逐渐变澄清。pH = 13时,混合体系中发生的主要反应的离子方程式为:_____________________。
Ⅰ.氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。请回答:
![]() (1)在一定体积的恒容密闭容器中,进行如下化学反应: N2(g)+3H2(g) 2NH3(g)
(1)在一定体积的恒容密闭容器中,进行如下化学反应: N2(g)+3H2(g) 2NH3(g)
其化学平衡常数K与温度t的关系如下表:
| t/K | 298 | 398 | 498 | … |
| K/(mol·L-1)2 | 4.1×106 | K1 | K2 | … |
完成下列问题:
①比较K1、K2的大小:K1 K2(填“>”、“=”或“<”)。
②判断该反应达到化学平衡状态的依据是 (填序号)。
A.2v(H2)(正)=3v(NH3)(逆) B.v(N2)(正)=3v(H2)(逆)
C.容器内压强保持不变 D.混合气体的密度保持不变
(2)盐酸肼(N2H6Cl2)是一种重要的化工原料,属于离子化合物,易溶于水,溶液呈酸性,水解原理与NH4Cl类似。
①写出盐酸肼第一步水解反应的离子方程式 。
②盐酸肼水溶液中离子浓度的排列顺序正确的是 (填序号)。
A.c(Cl-)>c(N2H62+)>c(H+)>c(OH-)
B.c(Cl-)>c([N2H5·H2O+])> c(H+)>c(OH-)
C.c(N2H62+)+ c([N2H5·H2O+])+c(H+)= c(Cl-)+c(OH-)
D.c(N2H62+)> c(Cl-)>c(H+)>c(OH-)
Ⅱ.水体中重金属铅的污染问题备受关注。查资料得知Pb4+具有很强的氧化性。水中铅的存在形态主要有Pb2+、Pb(OH)+、Pb(OH)2(在水中溶解度小)、Pb(OH)3-、Pb(OH)42-,各形态的物质的量的分数α随溶液pH变化的关系如下图所示:
 |
(1)Pb(NO3)2溶液中,c(Pb2+)/c(NO3-) 1/2(填“>”、“=”、“<”)。
(2)向Pb(NO3)2溶液滴加盐酸,溶液中c(Pb2+)/c(NO3-)没有变大,反而变小并有沉淀生成,则生成的沉淀可能为 。
(3)向Pb(NO3)2溶液中滴加NaOH溶液,溶液也变浑浊,在pH约为 时生成沉淀最多,继续滴加NaOH溶液,混合体系又逐渐变澄清。pH = 13时,混合体系中发生的主要反应的离子方程式为: 。
查看习题详情和答案>>Ⅰ.氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。请回答:
![]() (1)在一定体积的恒容密闭容器中,进行如下化学反应: N2(g)+3H2(g) 2NH3(g)
(1)在一定体积的恒容密闭容器中,进行如下化学反应: N2(g)+3H2(g) 2NH3(g)
其化学平衡常数K与温度t的关系如下表:
| t/K | 298 | 398 | 498 | … |
| K/(mol·L-1)2 | 4.1×106 | K1 | K2 | … |
完成下列问题:
①比较K1、K2的大小:K1 K2(填“>”、“=”或“<”)。
②判断该反应达到化学平衡状态的依据是 (填序号)。
A.2v(H2)(正)=3v(NH3)(逆) B.v(N2)(正)=3v(H2)(逆)
C.容器内压强保持不变 D.混合气体的密度保持不变
(2)盐酸肼(N2H6Cl2)是一种重要的化工原料,属于离子化合物,易溶于水,溶液呈酸性,水解原理与NH4Cl类似。
①写出盐酸肼第一步水解反应的离子方程式 。
②盐酸肼水溶液中离子浓度的排列顺序正确的是 (填序号)。
A.c(Cl-)>c(N2H62+)>c(H+)>c(OH-)
B.c(Cl-)>c([N2H5·H2O+])>c(H+)>c(OH-)
C.c(N2H62+)+ c([N2H5·H2O+])+c(H+)=c(Cl-)+c(OH-)
D.c(N2H62+)> c(Cl-)>c(H+)>c(OH-)
Ⅱ.水体中重金属铅的污染问题备受关注。查资料得知Pb4+具有很强的氧化性。水中铅的存在形态主要有Pb2+、Pb(OH)+、Pb(OH)2(在水中溶解度小)、Pb(OH)3-、Pb(OH)42-,各形态的物质的量的分数α随溶液pH变化的关系如下图所示:
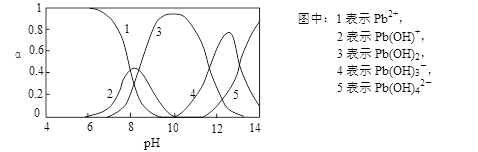 |
(1)Pb(NO3)2溶液中,c(Pb2+)/c(NO3-) 1/2(填“>”、“=”、“<”)。
(2)向Pb(NO3)2溶液滴加盐酸,溶液中c(Pb2+)/c(NO3-)没有变大,反而变小并有沉淀生成,则生成的沉淀可能为 。
(3)向Pb(NO3)2溶液中滴加NaOH溶液,溶液也变浑浊,在pH约为 时生成沉淀最多,继续滴加NaOH溶液,混合体系又逐渐变澄清。pH = 13时,混合体系中发生的主要反应的离子方程式为: 。
查看习题详情和答案>>