摘要:下列各物质均是中学化学中常见的物质.室温下,A.B.C为单质.且B在常温下为气体,A为固体.在一定条件下.它们可以按框图进行反应.又知D.E .F为化合物且D为固体.请按要求回答下列问题: (1)A元素是 B是 (2)若C是非金属,指出C在工业生产中的一种应用 . 若C是金属,C早在古代就可以通过湿法进行冶炼,则C是 (3)写出反应④的离子方程式为: (4)写出实验室用一种黑色粉末制取气体B的离子方程式: .
网址:http://m.1010jiajiao.com/timu3_id_169676[举报]
A-N是中学化学中常见的单质及化合物,A、B、F三种分子中的电子总数相同,A、C、D均为可燃性气体,B为无色液体;D、E、G、J、M为单质,其中J为黑色粉末,M为中学常见的金属,N可用作耐高温材料.各物质间存在下列转化关系(部分产物略去):
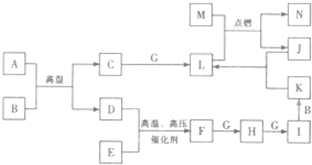
请回答下列问题:
(1)B的电子式为
(2)写出M与L反应的化学方程式
(3)写出加热条件下J与K的浓溶液反应的化学方程式
(4)简述实验室保存K的浓溶液的方法 .
查看习题详情和答案>>

请回答下列问题:
(1)B的电子式为
(2)写出M与L反应的化学方程式
(3)写出加热条件下J与K的浓溶液反应的化学方程式
(4)简述实验室保存K的浓溶液的方法
A-N是中学化学中常见的单质及化合物,A、B、F每个分子中电子总数相同,A、C、D均为可燃性气体,B通常为无色液体,D、E、G、J、M为单质,其中J为黑色粉末,M为中学常见的金属,N可用作耐高温材料。各物质间存在下列转化关系(部分产物略去)
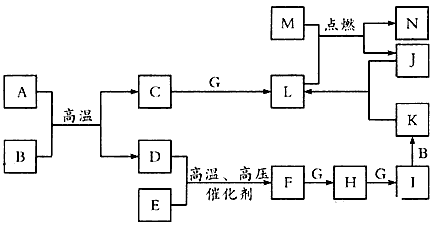
请回答下列问题:
(1)A的分子空间构型为_________
(2)写出M与L反应的化学方程式_____________。
(3)写出加热条件下J与K的热的浓溶液反应的化学方程式_________________。
(4)简述实验室保存K的浓溶液的方法_______________
查看习题详情和答案>>
(1)A的分子空间构型为_________
(2)写出M与L反应的化学方程式_____________。
(3)写出加热条件下J与K的热的浓溶液反应的化学方程式_________________。
(4)简述实验室保存K的浓溶液的方法_______________
图中各物质均由常见元素(原子序数≤20)组成。已知A、B、K为单质,且在常温下A和K为气体,B为固体。D为常见的无色液体。I是一种常用的化肥,在其水溶液中滴加AgNO3溶液有不溶于稀HNO3的白色沉淀产生。J是一种实验室常用的干燥剂。它们的相互转化关系如图所示(图中反应条件未列出)。请回答下列问题
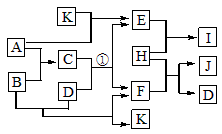
(1)I的化学式为_____________;J的电子式为__________________。
(2)反应①的化学方程式为_______________________________。
(3)F的水溶液与氯气反应的离子方程式为________________________________。
查看习题详情和答案>>
(2)反应①的化学方程式为_______________________________。
(3)F的水溶液与氯气反应的离子方程式为________________________________。
20.下图中各物质均由常见元素(原子序数≤20)组成。已知A、B、K为单质,且在常温下A和K为气体,B为固体。D为常见的无色液体。I是一种常用的化肥,在其水溶液中滴加AgNO3溶液有不溶于稀HNO3的白色沉淀产生。J是一种实验室常用的干燥剂。它们的相互转化关系如下图所示(图中反应条件未列出)。请回答下列问题:
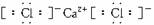
(1)I的化学式为 ;J的电子式为 。
(2)反应①的化学方程式为 。
(3)F的水溶液与氯气反应的离子方程式为 。
查看习题详情和答案>>CO是常见的化学物质,在工业生产中用途很广泛。
(1) 已知:某些反应的热化学方程式如下:
2H2(g)+SO2(g)=S(g)+2H2O(g) ΔH=+90.4kJ·mol-1
2CO(g)+O2(g)=2CO2(g) ΔH=-556.0kJ·mol-1
2H2(g)+O2(g)=2H2O(g) ΔH=-483.6kJ·mol-1
请写出用CO除去空气中SO2,生成S(g)及CO2热化学方程式
(2) 某燃料电池以CO为燃料,以空气为氧化剂,以熔融态的K2CO3为电解质,请写出该燃料电池正极的电极反应式 ;
(3)在某温度下、容积均为2L的三个密闭容器中,按不同方式投入反应物,保持恒温恒容,使之发生反应:2H2(g)+CO(g) CH3OH(g);△H=-dJ·mol-1(d>0)。初始投料与各容器达到平衡时的有关数据如下:
CH3OH(g);△H=-dJ·mol-1(d>0)。初始投料与各容器达到平衡时的有关数据如下:
| 实验 | 甲 | 乙 | 丙 |
| 初始投料 | 2 molH2、1 molCO | 1 mol CH3OH | 4 molH2、2 molCO |
| 平衡时n(CH3OH ) | 0.5mol | n2 | n3 |
| 反应的能量变化 | 放出Q1kJ | 吸收Q2kJ | 放出Q3kJ |
| 体系的压强 | P1 | P2 | P3 |
| 反应物的转化率 | α1 | α2 | α3 |
②三个容器中的反应分别达平衡时各组数据关系正确的是 (填序号)。
A.α1+α2=1 B.Q1+Q2=d
C.α3<α1 D.P3>2P1=2P2
E.n2<n3<1.0mol F.Q3<2Q1
③在其他条件不变的情况下,将甲容器的体系体积压缩到1L,若在第8min达到新的平衡,从开始到新平衡时H2的转化率为65.5%,请在下图中画出第5min 到新平衡时CH3OH的物质的量浓度的变化曲线。
(4)实验室常用甲酸(一元酸)来制备CO。已知25℃时,0.l mol/L甲酸( HCOOH)溶液和0.l mo1/L乙酸溶液的pH分别为2.3和2.9。现有相同物质的量浓度的下列四种溶液:①HCOONa溶液 ②CH3COONa溶液③Na2CO3④NaHCO3溶液,其pH由大到小的顺序是 ____(填写溶液序号)。关于0.l mo1/L HCOOH溶液和0.l mo1/LHCOONa等体积混合后的溶液描述正确的是 ____。
a.c(HCOOˉ)>c(HCOOH)>c(Na+)>c(H+)
b.c(HCOOˉ)+c(HCOOH)=" 0.2" mo1/L
c.c(HCOOˉ)+2c(OHˉ)=c(HCOOH)+2c(H+)
d.c(HCOOˉ) >c(Na+)>c(H+)>c(OHˉ) 查看习题详情和答案>>