摘要: 石灰石的主要成分是 .工业上有煅烧石灰石的方法制取生石灰.化学方程式为 . 热量.熟石灰由可做建筑材料.其原理是熟石灰与空气中的 反应.逐渐变成坚硬的 .从而把砖.碎石.沙子牢牢地黏合在一起.化学方程式为 .
网址:http://m.1010jiajiao.com/timu3_id_16967[举报]
工业上可以用食盐和石灰石为原料制取纯碱(Na2CO3),生产的关键是在沉淀池中让 NaCl、NH3、CO2和H2O尽可能多地转化成NaHCO3(固体沉淀物)和NH4Cl(溶液).主要生产流程如下:
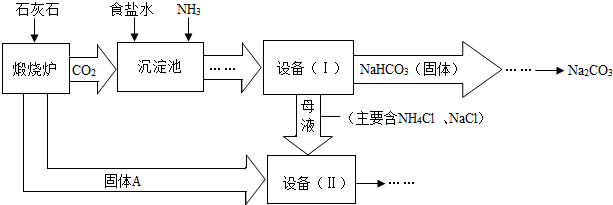
(已知2NH4CI+Ca(OH)2→CaCl2+2NH3↑+2H2O)
(1)“煅烧炉”中发生反应的化学方程式是 .
(2)若在化学实验室里分离“设备(I)”中的混合物,用到的操作名称是 .
(3)在“设备(Ⅱ)”中固体A与水反应的化学方程式是 .该反应属于 反应(填写基本反应类型).
(4)对“设备(Ⅱ)”中的母液处理后,除水以外可在本流程中再利用的物质有 (填写化学式).
(5)请写出一个该生产流程的优点: .
查看习题详情和答案>>

(已知2NH4CI+Ca(OH)2→CaCl2+2NH3↑+2H2O)
(1)“煅烧炉”中发生反应的化学方程式是
(2)若在化学实验室里分离“设备(I)”中的混合物,用到的操作名称是
(3)在“设备(Ⅱ)”中固体A与水反应的化学方程式是
(4)对“设备(Ⅱ)”中的母液处理后,除水以外可在本流程中再利用的物质有
(5)请写出一个该生产流程的优点:
工业上可以用食盐和石灰石为原料制取纯碱(Na2CO3),其关键是在沉淀池中让NaCl、NH3、CO2和H2O尽可能多地转化成NaHCO3(固体沉淀物)和NH4Cl(溶液).其主要生产流程如下:

已知:2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O
2NaHCO3
Na2CO3+CO2↑+H2O
试完成下列填空:
(1)煅烧炉中发生反应的化学方程式是
(2)在化学实验室里要分离设备(I)中的混合物,用到的操作名称是
(3)在设备(Ⅱ)中加入固体A时所有发生反应的化学方程式是
查看习题详情和答案>>

已知:2NH4Cl+Ca(OH)2
| ||
2NaHCO3
| ||
试完成下列填空:
(1)煅烧炉中发生反应的化学方程式是
CaCO3
CaO+CO2↑
| ||
CaCO3
CaO+CO2↑
,该反应属于
| ||
分解
分解
反应(填写基本反应类型).(2)在化学实验室里要分离设备(I)中的混合物,用到的操作名称是
过滤
过滤
,该操作所需的玻璃仪器有:烧杯、漏斗和玻璃棒
玻璃棒
.(3)在设备(Ⅱ)中加入固体A时所有发生反应的化学方程式是
H2O+CaO=Ca(OH)2
H2O+CaO=Ca(OH)2
、2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O
| ||
2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O
.
| ||
工业上可以用食盐和石灰石为原料制取纯碱(Na2CO3),生产的关键是在沉淀池中让NaCl、NH3、CO2和H2O尽可能多地转化成NaHCO3(固体沉淀物)和NH4Cl(溶液).主要生产流程如下:(已知2NH4Cl+Ca(OH)2=CaCl2+2NH3↑+2H2O)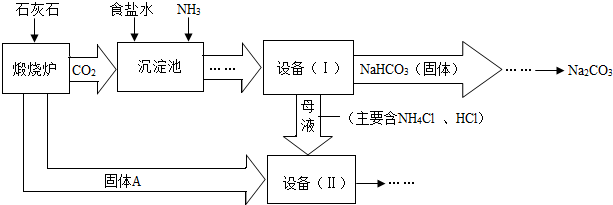
(1)“煅烧炉”中发生反应的化学方程式是
(2)若在化学实验室里分离“设备(I)”中的混合物,用到的操作名称是
(3)在“设备(Ⅱ)”中固体A与水反应的化学方程式是
(4)对“设备(Ⅱ)”中的母液处理后,除水以外可在本流程中再利用的物质有
(5)请写出纯碱(Na2CO3)的一点用途:
查看习题详情和答案>>

(1)“煅烧炉”中发生反应的化学方程式是
CaCO3
CaO+CO2↑
| ||
CaCO3
CaO+CO2↑
.
| ||
(2)若在化学实验室里分离“设备(I)”中的混合物,用到的操作名称是
过滤
过滤
,该操作中用到的玻璃仪器有烧杯、漏斗
漏斗
和玻璃棒
玻璃棒
.(3)在“设备(Ⅱ)”中固体A与水反应的化学方程式是
H2O+CaO=Ca(OH)2
H2O+CaO=Ca(OH)2
.(4)对“设备(Ⅱ)”中的母液处理后,除水以外可在本流程中再利用的物质有
NH3、NaCl
NH3、NaCl
(填写化学式).(5)请写出纯碱(Na2CO3)的一点用途:
用于玻璃、造纸、纺织或洗涤剂的生产等
用于玻璃、造纸、纺织或洗涤剂的生产等
.工业上可以用食盐和石灰石为原料制取纯碱(Na2CO3),生产的关键是在沉淀池中让 NaCl、NH3、CO2和H2O尽可能多地转化成NaHCO3(固体沉淀物)和NH4Cl(溶液).主要生产流程如下:
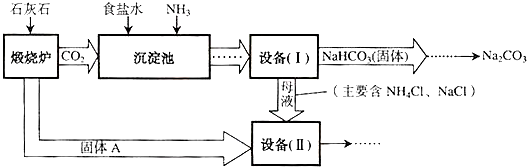
(1)NaHCO3俗称
(2)若在化学实验室里分离“设备(I)”中的混合物,用到的操作名称是
(3)写出设备( II)中发生的复分解反应的方程式
(4)对“设备(Ⅱ)”中的母液处理后,除水以外可在本流程中再利用的物质有
(5)某兴趣小组取80克石灰石样品进行煅烧实验(所含杂质在煅烧过程中不分解),测得反应后剩余固体的质量与时间的关系如下:
请回答下列问题:
①石灰石完全反应后生成二氧化碳的质量为
②该石灰石样品中碳酸钙的质量分数,写出计算过程.
查看习题详情和答案>>

(1)NaHCO3俗称
小苏打
小苏打
,该物质受热分解成碳酸钠和两种氧化物,写出反应的化学方程式2NaHCO3
Na2CO3+CO2↑+H2O
| ||
2NaHCO3
Na2CO3+CO2↑+H2O
,还可以用来治疗胃酸过多,反应方程式是
| ||
NaHCO3+HCl═NaCl+H2O+CO2↑
NaHCO3+HCl═NaCl+H2O+CO2↑
.(2)若在化学实验室里分离“设备(I)”中的混合物,用到的操作名称是
过滤
过滤
.(3)写出设备( II)中发生的复分解反应的方程式
Ca(OH)2+2NH4Cl═2NH3↑+2H2O+CaCl2
Ca(OH)2+2NH4Cl═2NH3↑+2H2O+CaCl2
.(4)对“设备(Ⅱ)”中的母液处理后,除水以外可在本流程中再利用的物质有
NaCl、NH3
NaCl、NH3
(填写化学式).(5)某兴趣小组取80克石灰石样品进行煅烧实验(所含杂质在煅烧过程中不分解),测得反应后剩余固体的质量与时间的关系如下:
| 反应时间 | T0 | T1 | T2 | T3 | T4 | T5 | T6 |
| 反应后固体的质量 | 80 | 75 | 70 | 66 | 62 | 58 | 58 |
①石灰石完全反应后生成二氧化碳的质量为
22
22
克.②该石灰石样品中碳酸钙的质量分数,写出计算过程.
工业上可以用食盐和石灰石为原料制取纯碱(Na2CO3),生产的关键是在沉淀池中让 NaCl、NH3、CO2和H2O尽可能多地转化成NaHCO3(固体沉淀物)和NH4Cl(溶液).主要生产流程如下:

(1)NaHCO3俗称______,该物质受热分解成碳酸钠和两种氧化物,写出反应的化学方程式______,还可以用来治疗胃酸过多,反应方程式是______.
(2)若在化学实验室里分离“设备(I)”中的混合物,用到的操作名称是______.
(3)写出设备( II)中发生的复分解反应的方程式______.
(4)对“设备(Ⅱ)”中的母液处理后,除水以外可在本流程中再利用的物质有______(填写化学式).
(5)某兴趣小组取80克石灰石样品进行煅烧实验(所含杂质在煅烧过程中不分解),测得反应后剩余固体的质量与时间的关系如下:
| 反应时间 | T0 | T1 | T2 | T3 | T4 | T5 | T6 |
| 反应后固体的质量 | 80 | 75 | 70 | 66 | 62 | 58 | 58 |
①石灰石完全反应后生成二氧化碳的质量为______克.
②该石灰石样品中碳酸钙的质量分数,写出计算过程. 查看习题详情和答案>>