摘要:26.有两种铁的氧化物A和B分别重0.4 g和0.435 g.在加热情况下.均用足量CO还原,把生成的CO2分别通人足量的澄清石灰水.均得到0.75 g沉淀.试确定两种铁的氧化物的化学式.
网址:http://m.1010jiajiao.com/timu3_id_169375[举报]
[化学一选修物质结构与性质]
A、B、C、D、E都是短周期主族元素,原子序数依次增大,B、C同周期,A、D同主族,E的单质既可溶于稀硫酸又可溶于氢氧化钠溶液.a、b能形成两种在常温下呈液态的化合物甲和乙,原子个数比分别为2:1和1:1.根据以上信息回答下列1-3问:
(1)C和D的离子中,半径较小的是______ (填离子符号).
(2)实验室在测定C的气态氢化物的相对分子质量时,发现实际测定值比理论值大出许多,其原因是______.
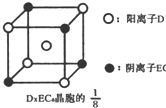
(3)C、D、E可组成离子化合物DxE6其晶胞(晶胞是在晶体中具有代表性的最小重复单元)结构如图所示,阳离子D+(用0表示)位于正方体的棱的中点和正方体内部;阴离子EC6x-(用

示)位于该正方体的顶点和面心,该化合物的化学式是______.
(4)Mn、Fe均为第四周期过渡元素,两元素的部分电离能数据列于下表:
回答下列问题:
Mn元素价电子层的电子排布式为______,比较两元素的I2J3可知,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难.对此的解释是______;
(5)Fe原子或离子外围有较多能量相近的空轨道而能与一些分子或离子形成配合物.
①与Fe原子或离子形成配合物的分子或离子应具备的结构特征是______.
②六氰合亚铁离子(Fe(CN)64-)中的配体CN-中c原子的杂化轨遣类型是______;
写出一种与CN-互为等电子体的单质分子的路易斯结构式______.
查看习题详情和答案>>
A、B、C、D、E都是短周期主族元素,原子序数依次增大,B、C同周期,A、D同主族,E的单质既可溶于稀硫酸又可溶于氢氧化钠溶液.a、b能形成两种在常温下呈液态的化合物甲和乙,原子个数比分别为2:1和1:1.根据以上信息回答下列1-3问:
(1)C和D的离子中,半径较小的是______ (填离子符号).
(2)实验室在测定C的气态氢化物的相对分子质量时,发现实际测定值比理论值大出许多,其原因是______.
(3)C、D、E可组成离子化合物DxE6其晶胞(晶胞是在晶体中具有代表性的最小重复单元)结构如图所示,阳离子D+(用0表示)位于正方体的棱的中点和正方体内部;阴离子EC6x-(用

示)位于该正方体的顶点和面心,该化合物的化学式是______.

(4)Mn、Fe均为第四周期过渡元素,两元素的部分电离能数据列于下表:
| 元素 | Mn | Fe | |
| 电离 能/kj?mol-1[来源:] |
Ⅰ1 | 717 | 759 |
| Ⅱ2 | 1509 | 1561 | |
| Ⅲ3 | 3248 | 2957 |
Mn元素价电子层的电子排布式为______,比较两元素的I2J3可知,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难.对此的解释是______;
(5)Fe原子或离子外围有较多能量相近的空轨道而能与一些分子或离子形成配合物.
①与Fe原子或离子形成配合物的分子或离子应具备的结构特征是______.
②六氰合亚铁离子(Fe(CN)64-)中的配体CN-中c原子的杂化轨遣类型是______;
写出一种与CN-互为等电子体的单质分子的路易斯结构式______.
[化学一选修物质结构与性质]
A、B、C、D、E都是短周期主族元素,原子序数依次增大,B、C同周期,A、D同主族,E的单质既可溶于稀硫酸又可溶于氢氧化钠溶液.a、b能形成两种在常温下呈液态的化合物甲和乙,原子个数比分别为2:1和1:1.根据以上信息回答下列1-3问:
(1)C和D的离子中,半径较小的是______ (填离子符号).
(2)实验室在测定C的气态氢化物的相对分子质量时,发现实际测定值比理论值大出许多,其原因是______.
(3)C、D、E可组成离子化合物DxE6其晶胞(晶胞是在晶体中具有代表性的最小重复单元)结构如图所示,阳离子D+(用0表示)位于正方体的棱的中点和正方体内部;阴离子EC6x-(用 示)位于该正方体的顶点和面心,该化合物的化学式是______.
示)位于该正方体的顶点和面心,该化合物的化学式是______.

(4)Mn、Fe均为第四周期过渡元素,两元素的部分电离能数据列于下表:
回答下列问题:
Mn元素价电子层的电子排布式为______,比较两元素的I2J3可知,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难.对此的解释是______;
(5)Fe原子或离子外围有较多能量相近的空轨道而能与一些分子或离子形成配合物.
①与Fe原子或离子形成配合物的分子或离子应具备的结构特征是______.
②六氰合亚铁离子(Fe(CN)64-)中的配体CN-中c原子的杂化轨遣类型是______;
写出一种与CN-互为等电子体的单质分子的路易斯结构式______.
查看习题详情和答案>>
A、B、C、D、E都是短周期主族元素,原子序数依次增大,B、C同周期,A、D同主族,E的单质既可溶于稀硫酸又可溶于氢氧化钠溶液.a、b能形成两种在常温下呈液态的化合物甲和乙,原子个数比分别为2:1和1:1.根据以上信息回答下列1-3问:
(1)C和D的离子中,半径较小的是______ (填离子符号).
(2)实验室在测定C的气态氢化物的相对分子质量时,发现实际测定值比理论值大出许多,其原因是______.
(3)C、D、E可组成离子化合物DxE6其晶胞(晶胞是在晶体中具有代表性的最小重复单元)结构如图所示,阳离子D+(用0表示)位于正方体的棱的中点和正方体内部;阴离子EC6x-(用
 示)位于该正方体的顶点和面心,该化合物的化学式是______.
示)位于该正方体的顶点和面心,该化合物的化学式是______.
(4)Mn、Fe均为第四周期过渡元素,两元素的部分电离能数据列于下表:
| 元素 | Mn | Fe | |
| 电离 能/kj?mol-1[来源:] | Ⅰ1 | 717 | 759 |
| Ⅱ2 | 1509 | 1561 | |
| Ⅲ3 | 3248 | 2957 |
Mn元素价电子层的电子排布式为______,比较两元素的I2J3可知,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难.对此的解释是______;
(5)Fe原子或离子外围有较多能量相近的空轨道而能与一些分子或离子形成配合物.
①与Fe原子或离子形成配合物的分子或离子应具备的结构特征是______.
②六氰合亚铁离子(Fe(CN)64-)中的配体CN-中c原子的杂化轨遣类型是______;
写出一种与CN-互为等电子体的单质分子的路易斯结构式______.
查看习题详情和答案>>
(2011?西安模拟)[化学一选修物质结构与性质]
A、B、C、D、E都是短周期主族元素,原子序数依次增大,B、C同周期,A、D同主族,E的单质既可溶于稀硫酸又可溶于氢氧化钠溶液.a、b能形成两种在常温下呈液态的化合物甲和乙,原子个数比分别为2:1和1:1.根据以上信息回答下列1-3问:
(1)C和D的离子中,半径较小的是
(2)实验室在测定C的气态氢化物的相对分子质量时,发现实际测定值比理论值大出许多,其原因是
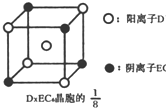
(3)C、D、E可组成离子化合物DxE6其晶胞(晶胞是在晶体中具有代表性的最小重复单元)结构如图所示,阳离子D+(用0表示)位于正方体的棱的中点和正方体内部;阴离子EC6x-(用 示)位于该正方体的顶点和面心,该化合物的化学式是
示)位于该正方体的顶点和面心,该化合物的化学式是
(4)Mn、Fe均为第四周期过渡元素,两元素的部分电离能数据列于下表:
回答下列问题:
Mn元素价电子层的电子排布式为
(5)Fe原子或离子外围有较多能量相近的空轨道而能与一些分子或离子形成配合物.
①与Fe原子或离子形成配合物的分子或离子应具备的结构特征是
②六氰合亚铁离子(Fe(CN)64-)中的配体CN-中c原子的杂化轨遣类型是
写出一种与CN-互为等电子体的单质分子的路易斯结构式
查看习题详情和答案>>
A、B、C、D、E都是短周期主族元素,原子序数依次增大,B、C同周期,A、D同主族,E的单质既可溶于稀硫酸又可溶于氢氧化钠溶液.a、b能形成两种在常温下呈液态的化合物甲和乙,原子个数比分别为2:1和1:1.根据以上信息回答下列1-3问:
(1)C和D的离子中,半径较小的是
Na+
Na+
(填离子符号).(2)实验室在测定C的气态氢化物的相对分子质量时,发现实际测定值比理论值大出许多,其原因是
由于HF中含有氢键相结合的聚合氟化氢分子(HF)n
由于HF中含有氢键相结合的聚合氟化氢分子(HF)n
.(3)C、D、E可组成离子化合物DxE6其晶胞(晶胞是在晶体中具有代表性的最小重复单元)结构如图所示,阳离子D+(用0表示)位于正方体的棱的中点和正方体内部;阴离子EC6x-(用
 示)位于该正方体的顶点和面心,该化合物的化学式是
示)位于该正方体的顶点和面心,该化合物的化学式是Na3AlF6
Na3AlF6
.
(4)Mn、Fe均为第四周期过渡元素,两元素的部分电离能数据列于下表:
| 元素 | Mn | Fe | |
| 电离 能/kJ?mol-1 |
Ⅰ1 | 717 | 759 |
| Ⅱ2 | 1509 | 1561 | |
| Ⅲ3 | 3248 | 2957 |
Mn元素价电子层的电子排布式为
3d54s2
3d54s2
,比较两元素的I2J3可知,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难.对此的解释是由Mn2+转化为Mn3+时,3d能级由较稳定的3d5半充满状态转为不稳定的3d4状态需要的能量较多;而Fe2+到Fe3+时,3d能级由不稳定的3d6到稳定的3d5半充满状态,需要的能量相对要少
由Mn2+转化为Mn3+时,3d能级由较稳定的3d5半充满状态转为不稳定的3d4状态需要的能量较多;而Fe2+到Fe3+时,3d能级由不稳定的3d6到稳定的3d5半充满状态,需要的能量相对要少
;(5)Fe原子或离子外围有较多能量相近的空轨道而能与一些分子或离子形成配合物.
①与Fe原子或离子形成配合物的分子或离子应具备的结构特征是
具有弧对电子
具有弧对电子
.②六氰合亚铁离子(Fe(CN)64-)中的配体CN-中c原子的杂化轨遣类型是
sp
sp
;写出一种与CN-互为等电子体的单质分子的路易斯结构式
N≡N
N≡N
.(1)下图是一种用于显示事物异同点的信息处理方法。例如A图中的两个圆分别代表铝和铁的有关信息,两圆重叠的区域表示铝和铁的共同点(相似点),重叠区域以外的部分表示它们独有的特征(不同点)。请你在下面横线上用化学方程式来表示与图中①②区域对应的化学性质上的不同之处(每处只要求写一个)。
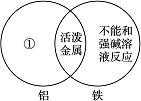 A
A
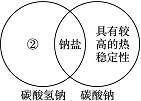 B
B
①________________________________________________________________________;
②________________________________________________________________________;
(2)为了测定铁铝合金中金属的质量分数,某校研究性学习小组设计了如下实验操作过程:称取该合金1.0g,放入烧杯中加足量盐酸,盖上表面皿,使其充分反应;反应停止,经冷却向其中加入过量NaOH溶液,充分静置后过滤,对滤出的沉淀经洗涤在空气中加热灼烧至恒重,得到固体物质1.2g。下列有关叙述不正确的是________。
A.铁的质量为0.84g
B.Al的质量分数为16%
C.加入过量NaOH溶液的目的是为了Fe2+完全沉淀
D.加入NaOH溶液后充分静置是为了保证Fe(OH)2被空气中的氧气充分氧化为Fe(OH)3
(3)Al(OH)3和NaHCO3都是治疗胃酸过多的药物,用离子方程式表示其原理,________________,______________。根据上述反应,如果是胃酸过多且有胃溃疡的患者,应该选用上述哪一种药物治疗为好________,理由是________________________。
查看习题详情和答案>>