摘要:现有以下物质:①空气.②氢氧化钠.③硫酸.④盐酸.⑤银.⑥蔗糖.⑦CCl4.其中属于混合物的有 .属于单质的有 .属于电解质的有 .
网址:http://m.1010jiajiao.com/timu3_id_169235[举报]
过氧化钙(CaO2)难溶于水,在常温下稳定,在潮湿空气及水中缓慢分解放出氧气,因而广泛应用于渔业、农业、环保等许多方面.如图是以大理石(主要杂质是氧化铁)等为原料制取过氧化钙(CaO2)的流程.

请回答下列问题:
(1)操作①应包括下列操作中的
A.溶解 B.过滤 C.蒸馏 D.分液 E.蒸发结晶
(2)用氨水调节pH至8~9的目的是
(3)若测得滤液C中c(CO32-)=10-3 mol/L,则Ca2+
(4)若在滤液C中,加入HNO3使溶液呈酸性以得到副产物NH4NO3,则酸化后溶液中,c(NH4+)
(5)操作②是:在低温下,往过氧化氢浓溶液中投入无水氯化钙进行反应,写出该反应的化学方程式
查看习题详情和答案>>

请回答下列问题:
(1)操作①应包括下列操作中的
ABE
ABE
(填序号).A.溶解 B.过滤 C.蒸馏 D.分液 E.蒸发结晶
(2)用氨水调节pH至8~9的目的是
除去Fe3+
除去Fe3+
.(3)若测得滤液C中c(CO32-)=10-3 mol/L,则Ca2+
是
是
(填“是”或“否”)沉淀完全.[已知c(Ca2+)≤10-5mol/L可视为沉淀完全;Ksp(CaCO3)=4.96×10-9](4)若在滤液C中,加入HNO3使溶液呈酸性以得到副产物NH4NO3,则酸化后溶液中,c(NH4+)
<
<
c(NO3-)(填“≥”、“≤”、“<”、“>”或“=”)(5)操作②是:在低温下,往过氧化氢浓溶液中投入无水氯化钙进行反应,写出该反应的化学方程式
CaCl2+H2O2 CaO2+2HCl
CaO2+2HCl
 CaO2+2HCl
CaO2+2HClCaCl2+H2O2 CaO2+2HCl
CaO2+2HCl
.一段时间后,再加入氢氧化钠溶液,当调节溶液pH至9~11,才出现大量沉淀.用简要的文字解释需用氢氧化钠调节pH至9~11的原因 CaO2+2HCl
CaO2+2HCl入NaOH溶液使上述平衡向正反应方向,有利于CaO2沉淀的生成
入NaOH溶液使上述平衡向正反应方向,有利于CaO2沉淀的生成
. 为了测出某氢氧化钠溶液的物质的量浓度,某研究性学习小组先用广泛pH试纸测出该溶液的pH,发现该溶液的pH=14.于是他们用碱式滴定管量取25.00mL待测氢氧化钠溶液盛放在锥形瓶中,把0.1000mol/L的标准盐酸溶液注入50mL的酸式滴定管中,然后进行中和滴定操作.
为了测出某氢氧化钠溶液的物质的量浓度,某研究性学习小组先用广泛pH试纸测出该溶液的pH,发现该溶液的pH=14.于是他们用碱式滴定管量取25.00mL待测氢氧化钠溶液盛放在锥形瓶中,把0.1000mol/L的标准盐酸溶液注入50mL的酸式滴定管中,然后进行中和滴定操作.回答下列问题:
(1)用酚酞作指示剂,50.00mL标准盐酸溶液滴定完全后,锥形瓶内溶液颜色仍然呈红色,原因是
(2)为了继续完成该实验,他们取待测氢氧化钠溶液25mL稀释成250mL,然后再进行中和滴定.稀释该氢氧化钠溶液的玻璃仪器有
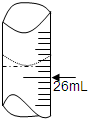
(3)用标准盐酸溶液滴定稀释后的碱溶液25.00mL,滴定前滴定管内液面读数为1.10mL,滴定后液面如图所示,则消耗标准溶液的体积为
(4)以下操作会导致结果偏高的是
A.待测碱溶液要空气中暴露时间较长B.未用标准液润洗酸式滴定管C.滴定终点读数时发现滴定管尖嘴处悬挂一滴溶液D.滴定终点读数时俯视滴定管的刻度,其他操作都正确
E.锥形瓶用蒸馏水润洗后再用待测液润洗.
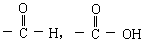 。
。 应生成A;(4)E可以由B氧化制取;(5)F能氧化成最简单的醛。根据上述条件,请推断A B C
应生成A;(4)E可以由B氧化制取;(5)F能氧化成最简单的醛。根据上述条件,请推断A B C