题目内容
 为了测出某氢氧化钠溶液的物质的量浓度,某研究性学习小组先用广泛pH试纸测出该溶液的pH,发现该溶液的pH=14.于是他们用碱式滴定管量取25.00mL待测氢氧化钠溶液盛放在锥形瓶中,把0.1000mol/L的标准盐酸溶液注入50mL的酸式滴定管中,然后进行中和滴定操作.
为了测出某氢氧化钠溶液的物质的量浓度,某研究性学习小组先用广泛pH试纸测出该溶液的pH,发现该溶液的pH=14.于是他们用碱式滴定管量取25.00mL待测氢氧化钠溶液盛放在锥形瓶中,把0.1000mol/L的标准盐酸溶液注入50mL的酸式滴定管中,然后进行中和滴定操作.回答下列问题:
(1)用酚酞作指示剂,50.00mL标准盐酸溶液滴定完全后,锥形瓶内溶液颜色仍然呈红色,原因是
(2)为了继续完成该实验,他们取待测氢氧化钠溶液25mL稀释成250mL,然后再进行中和滴定.稀释该氢氧化钠溶液的玻璃仪器有
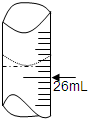
(3)用标准盐酸溶液滴定稀释后的碱溶液25.00mL,滴定前滴定管内液面读数为1.10mL,滴定后液面如图所示,则消耗标准溶液的体积为
(4)以下操作会导致结果偏高的是
A.待测碱溶液要空气中暴露时间较长B.未用标准液润洗酸式滴定管C.滴定终点读数时发现滴定管尖嘴处悬挂一滴溶液D.滴定终点读数时俯视滴定管的刻度,其他操作都正确
E.锥形瓶用蒸馏水润洗后再用待测液润洗.
(2)根据配制一定物质的量浓度的溶液使用的仪器解答;根据量筒和滴定管的准确度分析对该实验结果的影响;
(3)根据滴定管的构造读出滴定末读数,计算出消耗标准液的体积;根据氢氧化钠与氯化氢反应的关系式及滴定数据计算出氢氧化钠的浓度;
(4)根据实验操作对c(待测)=
| c(标准)×V(标准) |
| V(待测) |
故答案为:氢氧化钠没有反应完全(或其他合理表述);
(2)取待测氢氧化钠溶液25mL稀释成250mL,需要使用的仪器有:碱式滴定管、烧杯、250mL容量瓶、胶头滴管,所以还缺少250mL容量瓶;由于量筒的准确度为0.1mL,而滴定管的准确度为0.01mL,所以量筒的精确度较低,会影响滴定结果,
故答案为:250mL容量瓶;量筒的精确度较低;
(3)滴定管0刻度在上方,每个小刻度为0.01mL,图中液面读数为25.80mL,所以消耗标准溶液的体积为:(25.80-1.10)mL=24.70mL;
氢氧化钠与盐酸反应的关系式为:NaOH~HCl,n(NaOH)=n(HCl),c(待测)=
| c(标准)×V(标准) |
| V(待测) |
| 0.1000mol/L×24.70mL |
| 25.0mL |
故答案为:24.70mL;0.988mol/L;
(4)A.待测碱溶液要空气中暴露时间较长,部分氢氧化钠生成了碳酸钠,但是用标准液盐酸滴定时,反应最终都生成了氯化钠,根据钠原子守恒,不影响滴定结果,故A错误;
B.未用标准液润洗酸式滴定管,导致标准液被稀释,浓度减小,滴定时消耗的标准液体积偏大,根据c(待测)=
| c(标准)×V(标准) |
| V(待测) |
C.滴定终点读数时发现滴定管尖嘴处悬挂一滴溶液,导致消耗的标准液体积偏大,根据c(待测)=
| c(标准)×V(标准) |
| V(待测) |
D.滴定终点读数时俯视滴定管的刻度,导致标准液体积读数偏小,最终消耗的标准液体积偏小,根据c(待测)=
| c(标准)×V(标准) |
| V(待测) |
E.锥形瓶用蒸馏水润洗后再用待测液润洗,导致待测液的物质的量偏大,滴定过程中消耗的标准液体积偏大,根据c(待测)=
| c(标准)×V(标准) |
| V(待测) |
故选BCE.

(1)实验室制取氯气也可用下图装置

①实验原理(写化学方程式):______________________________。
②收集原理:因Cl2溶于水,密度比空气大,故用向上排空气法;因Cl2在饱和食盐水中的溶解度小,故可用排饱和食盐水法收集。A、B为两个位置上的止水夹,采用向上排空气法和排饱和食盐水法收集Cl2时的正确操作是_________________________________________。
A.采用向上排空气法收集Cl2时应将A关闭,B打开
B.采用向上排空气法收集Cl2时应将B关闭,A打开
C.采用排饱和食盐水法收集Cl2时应将A关闭,B打开
D.采用排饱和食盐水法收集Cl2时应将B关闭,A打开
③尾气处理,氢氧化钠溶液的作用是处理尾气,防止氯气污染空气,该反应的离子方程式为:__________________________________________________________________。
(2)科学研究中可以用多种方法来测定阿伏加德罗常数。X射线衍射法就是其中的一种。X射线法是通过X射线衍射仪测出离子化合物离子间的间隔,再根据该化合物质量与体积的关系(密度)来确定。已知:X射线衍射仪测出的NaCl晶体中相邻钠离子与氯离子间距为a cm,NaCl相对分子质量为b。某同学为了测定阿伏加德罗常数,做了如下实验:用分析天平称取一定质量研细的NaCl固体,装入25 mL容量瓶中,然后用滴定管向容量瓶中滴加苯并不断振荡,使苯、氯化钠晶体充分混匀,标定,其实验结果如下表:
实验序号 | m NaCl/g | 消耗苯体积/cm3 | VNaCl | NA |
1 | 5.879 3 | 22.27 |
|
|
2 | 9.456 6 | 20.67 |
|
|
根据实验数据,请填写第一次实验中的空格(阿伏加德罗常数项只要求写出计算式,对原始数据不进行处理)。