网址:http://m.1010jiajiao.com/timu3_id_169218[举报]
(1)从下列用品中选出实验所需要的仪器或用品(填序号)( )
A.500 mL烧杯 B.100 mL烧杯
C.10 mL量筒 D.25.0 mL酸式滴定管
E.500 mL容量瓶 F.1 000 mL 容量瓶
G.广口瓶 H.托盘天平
I.玻璃棒
除选用上述仪器外,尚缺少的仪器或用品是____________。
(2)某学生通过计算后的实验操作如下:a.用25.0 mL酸式滴定管量取5.43 mL浓硫酸;b.向量筒中加入少量蒸馏水,并用玻璃棒搅拌;c.立即将稀释后的溶液转入容量瓶中;d.然后小心地往容量瓶中加蒸馏水至刻度线;e.把容量瓶盖盖紧,再振荡摇匀。指出上述实验过程中的错误之处____________。
查看习题详情和答案>>物质 | 熔点( ℃) | 沸点( ℃) | 密度(g·cm-3) |
乙醇 | -117.0 | 78.0 | 0.79 |
乙酸 | 16.6 | 117.9 | 1.05 |
乙酸乙酯 | -83.6 | 77.5 | 0.90 |
浓硫酸(98%) | —— | 338.0 | 1.84 |
学生在实验室制取乙酸乙酯的主要步骤如下:
①在30 mL的大试管A中按体积比1∶4∶4的比例配制浓硫酸、乙醇和乙酸的混合溶液。
②按下图连接好装置(装置气密性良好),用小火均匀地加热装有混合溶液的大试管5—10 min。
③待试管B收集到一定量产物后停止加热,撤出试管B并用力振荡,然后静置待分层。
④分离出乙酸乙酯层,洗涤、干燥。


图1 图2
请根据题目要求完成下列问题:
(1)配制该混合溶液的主要操作步骤为:___________________________________________;
写出制取乙酸乙酯的化学方程式:________________________________________________。
(2)上述实验中饱和碳酸钠溶液的作用是(填字母):_______________。
A.中和乙酸和乙醇
B.中和乙酸并吸收部分乙醇
C.乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中更小,有利于分层析出
D.加速酯的生成,提高其产率
(3)步骤②中需要小火均匀加热操作,其主要理由是:_______________________________。
(4)指出步骤③所观察到的现象:_____________________________;分离出乙酸乙酯层后,一般用饱和食盐水和饱和氯化钙溶液洗涤,可通过洗涤除去(填名称)_____________ 等杂质;为了干燥乙酸乙酯可选用的干燥剂为(填字母):_____________。
A.P2O5 B.无水Na2SO4 C.碱石 D.NaOH固体
(5)某化学课外小组设计了如图2所示的制取乙酸乙酯的装置(图中的铁架台、铁夹、加热装置已略去),与图1装置相比,图2装置的主要优点有:_____________________。
查看习题详情和答案>>物质 | 熔点( ℃) | 沸点( ℃) | 密度(g·cm-3) |
乙醇 | -117.0 | 78.0 | 0.79 |
乙酸 | 16.6 | 117.9 | 1.05 |
乙酸乙酯 | -83.6 | 77.5 | 0.90 |
浓硫酸(98%) | —— | 338.0 | 1.84 |
学生在实验室制取乙酸乙酯的主要步骤如下:
①在30 mL的大试管A中按体积比1∶4∶4的比例配制浓硫酸、乙醇和乙酸的混合溶液。
②按下图连接好装置(装置气密性良好),用小火均匀地加热装有混合溶液的大试管5—10 min。
③待试管B收集到一定量产物后停止加热,撤出试管B并用力振荡,然后静置待分层。
④分离出乙酸乙酯层,洗涤、干燥。


图1 图2
请根据题目要求完成下列问题:
(1)配制该混合溶液的主要操作步骤为:___________________________________________;
写出制取乙酸乙酯的化学方程式:________________________________________________。
(2)上述实验中饱和碳酸钠溶液的作用是(填字母):_______________。
A.中和乙酸和乙醇
B.中和乙酸并吸收部分乙醇
C.乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中更小,有利于分层析出
D.加速酯的生成,提高其产率
(3)步骤②中需要小火均匀加热操作,其主要理由是:_______________________________。
(4)指出步骤③所观察到的现象:_____________________________;分离出乙酸乙酯层后,一般用饱和食盐水和饱和氯化钙溶液洗涤,可通过洗涤除去(填名称)_____________ 等杂质;为了干燥乙酸乙酯可选用的干燥剂为(填字母):_____________。
A.P2O5 B.无水Na2SO4 C.碱石 D.NaOH固体
(5)某化学课外小组设计了如图2所示的制取乙酸乙酯的装置(图中的铁架台、铁夹、加热装置已略去),与图1装置相比,图2装置的主要优点有:_____________________。
查看习题详情和答案>>(15分)X、Y、Z、W四种物质有如下相互转化关系(其中X、W单质,Y、Z为化合物,未列出反应条件)。
Ⅰ.若Z是生活中常用的调味品,W遇淀粉溶液变蓝,则:
(1)常温下,X的颜色是 。
(2)工业上Z有多种用途,用化学方程式表示Z的一种用途 。
(3)生活中所用的Z加入了碘酸钾,过量X与Y溶液反应时可以得到一种碘酸盐,此反应的离子方程式是 。
Ⅱ.下面是某化学课外活动小组研究浓H2SO4的氧化性的结论并进行了实验验证:
①一般认为H2SO4浓度大于60%,就具有一定的强氧化性,越浓氧化性越强,60%以下的H2SO4主要体现的是酸性,基本上不体现强氧化性。
②温度也影响氧化性,如铜放于冷的浓H2SO4中反应不明显,如果加热就可以观察到明显现象。
③98%的浓H2SO4物质的量浓度为18.4 mol/L,密度为1.84 g·cm-3,根据以上信息回答:?
(1)如图装置,同学甲先向带支管的试管中放入铜粉和3 mL水,然后从分液漏斗中加98%的浓H2SO40.5 mL,加热至沸腾,该试管中液体没有明显变化,试用数据解释
原因 。
(2)乙同学利用所示装置直接从分液漏斗中再加浓H2SO410 mL与铜片反应。在左边试管中所观察到与甲不同的现象除了有黑色物质出现外,还有
① ,
原因是 。
② ,
原因是 。
查看习题详情和答案>>
(15分)X、Y、Z、W四种物质有如下相互转化关系(其中X、W单质,Y、Z为化合物,未列出反应条件)。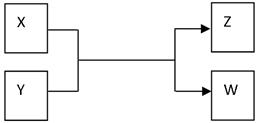
Ⅰ.若Z是生活中常用的调味品,W遇淀粉溶液变蓝,则:
(1)常温下,X的颜色是 。
(2)工业上Z有多种用途,用化学方程式表示Z的一种用途 。
(3)生活中所用的Z加入了碘酸钾,过量X与Y溶液反应时可以得到一种碘酸盐,此反应的离子方程式是 。
Ⅱ.下面是某化学课外活动小组研究浓H2SO4的氧化性的结论并进行了实验验证:
①一般认为H2SO4浓度大于60%,就具有一定的强氧化性,越浓氧化性越强,60%以下的H2SO4主要体现的是酸性,基本上不体现强氧化性。
②温度也影响氧化性,如铜放于冷的浓H2SO4中反应不明显,如果加热就可以观察到明显现象。
③98%的浓H2SO4物质的量浓度为18.4 mol/L,密度为1.84 g·cm-3,根据以上信息回答:?
(1)如图装置,同学甲先向带支管的试管中放入铜粉和3 mL水,然后从分液漏斗中加98%的浓H2SO4 0.5 mL,加热至沸腾,该试管中液体没有明显变化,试用数据解释
原因 。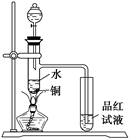
(2)乙同学利用所示装置直接从分液漏斗中再加浓H2SO4 10 mL与铜片反应。在左边试管中所观察到与甲不同的现象除了有黑色物质出现外,还有
① ,
原因是 。
② ,
原因是 。