摘要:为除去粗盐中的Ca 2+.Mg 2+.SO4 2-及泥沙.可将粗盐溶于水.然后进行下列五项操作:①过滤 ②加过量NaOH溶液③加适量盐酸④加过量Na2CO3溶液⑤加过量BaCl2溶液 正确的操作顺序是 A.①④②⑤③ B.④①②⑤③ C.②⑤④①③ D.⑤②④①③
网址:http://m.1010jiajiao.com/timu3_id_168595[举报]
为除去粗盐中的Ca2+、Mg2+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):

(1)步骤②中应加入的试剂是
(2)步骤④中应加入的试剂是
(3)若将第⑤步和第⑥步颠倒,会对实验结果产生影响,其原因是
(4)②③④中所加试剂的顺序也可以调整为
A ③②④B ④③②C ②④③D ④②③
查看习题详情和答案>>

(1)步骤②中应加入的试剂是
BaCl2
BaCl2
溶液,判断此试剂已加过量的方法是取少量上层澄清液于试管中,滴加氯化钡溶液,不再产生白色沉淀,证明氯化钡溶液已滴加过量.或取少量上层澄清液于试管中,滴加稀硫酸,产生白色沉淀,证明氯化钡溶液已滴加过量
取少量上层澄清液于试管中,滴加氯化钡溶液,不再产生白色沉淀,证明氯化钡溶液已滴加过量.或取少量上层澄清液于试管中,滴加稀硫酸,产生白色沉淀,证明氯化钡溶液已滴加过量
.(2)步骤④中应加入的试剂是
Na2CO3
Na2CO3
溶液,第④步中相关的离子方程式是Ca2++CO32-=CaCO3↓、Ba2++CO32-=BaCO3↓
Ca2++CO32-=CaCO3↓、Ba2++CO32-=BaCO3↓
.(3)若将第⑤步和第⑥步颠倒,会对实验结果产生影响,其原因是
会使CaCO3、BaCO3、Mg(OH)2沉淀溶解,重新引入Ca2+、Ba2+、Mg2+
会使CaCO3、BaCO3、Mg(OH)2沉淀溶解,重新引入Ca2+、Ba2+、Mg2+
(4)②③④中所加试剂的顺序也可以调整为
A
A
A ③②④B ④③②C ②④③D ④②③
为除去粗盐中的Ca2+、Mg2+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):

(1)判断BaCl2已过量的方法是
(2)第④步中,有关的离子方程式是
(3)下列仪器,蒸发结晶时会用到的是
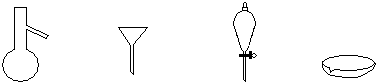
(4)为检验精盐纯度,需配制1000mL 0.2mol/L NaCl(精盐)溶液,回答下列问题:
①人们常将配制过程简述为以下各步骤:A.冷却;B.称量;C.洗涤;D.定容;E.溶解;F.摇匀;G.转移;H.装瓶.其正确的操作顺序应是
(A)B E F G C G D H A (B)B E G A C G F D H
(C)B E A G C G D F H (D)B E A G C G D H F
②若定容时观察液面仰视,会造成所配制的溶液浓度(填“偏高”或“偏低”)
查看习题详情和答案>>

(1)判断BaCl2已过量的方法是
取少量②中上层清液于试管中,向其中滴加BaCl2溶液,若无沉淀产生,则BaCl2溶液已过量
取少量②中上层清液于试管中,向其中滴加BaCl2溶液,若无沉淀产生,则BaCl2溶液已过量
(2)第④步中,有关的离子方程式是
Ca2++CO32-=CaCO3↓Ba2++CO32-=BaCO3↓
Ca2++CO32-=CaCO3↓Ba2++CO32-=BaCO3↓
.(3)下列仪器,蒸发结晶时会用到的是
蒸发皿
蒸发皿
(写仪器名称)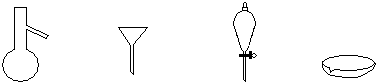
(4)为检验精盐纯度,需配制1000mL 0.2mol/L NaCl(精盐)溶液,回答下列问题:
①人们常将配制过程简述为以下各步骤:A.冷却;B.称量;C.洗涤;D.定容;E.溶解;F.摇匀;G.转移;H.装瓶.其正确的操作顺序应是
C
C
(填序号).(A)B E F G C G D H A (B)B E G A C G F D H
(C)B E A G C G D F H (D)B E A G C G D H F
②若定容时观察液面仰视,会造成所配制的溶液浓度(填“偏高”或“偏低”)
偏低
偏低
.为除去粗盐中的少量Ca2+、Mg2+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如图(用于沉淀的试剂稍过量):
称取粗盐
滤液
精盐
(1)加入过量BaCl2溶液的目的是除去粗盐中的
(2)加入过量 Na2CO3溶液的目的是
(3)第③步的目的是除去粗盐中的Mg2+,反应的离子方程式为
查看习题详情和答案>>
称取粗盐
| 溶解 |
| ① |
| BaCL2 |
| ② |
| ||
| ③ |
| Na2CO3 |
| ④ |
| 过滤 |
| ⑤ |
| 适量盐酸 |
| ⑥ |
| 蒸发、结晶、烘干 |
| ⑦ |
(1)加入过量BaCl2溶液的目的是除去粗盐中的
SO42-
SO42-
.(2)加入过量 Na2CO3溶液的目的是
除去Ca2+和Ba2+
除去Ca2+和Ba2+
.(3)第③步的目的是除去粗盐中的Mg2+,反应的离子方程式为
Mg2++2OH-═Mg(OH)2
Mg2++2OH-═Mg(OH)2
.为除去粗盐中的Ca2+、Mg2+、SO
以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):

(1)在第①步和第⑤步中都需要用到玻璃棒,其作用分别是
(2)判断BaCl2已过量的方法是
(3)第④步中,相关的离子方程式是
(4)若先用盐酸再过滤,将对实验结果产生影响,其原因是
查看习题详情和答案>>
2- 4 |

(1)在第①步和第⑤步中都需要用到玻璃棒,其作用分别是
搅拌,加快溶解
搅拌,加快溶解
、引流
引流
.(2)判断BaCl2已过量的方法是
取少量②中上层清液于试管中,向其中滴加BaCl2溶液,若无沉淀产生,则BaCl2溶液已过量;
取少量②中上层清液于试管中,向其中滴加BaCl2溶液,若无沉淀产生,则BaCl2溶液已过量;
.(3)第④步中,相关的离子方程式是
Ca2++CO32-=CaCO3↓,Ba2++CO32-=BaCO3↓
Ca2++CO32-=CaCO3↓,Ba2++CO32-=BaCO3↓
.(4)若先用盐酸再过滤,将对实验结果产生影响,其原因是
会有部分沉淀如CaCO3、Mg(OH)2、BaCO3溶解,离子重新进入溶液,从而影响制得精盐的纯度
会有部分沉淀如CaCO3、Mg(OH)2、BaCO3溶解,离子重新进入溶液,从而影响制得精盐的纯度
.为除去粗盐中的Ca2+、Mg2+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量)
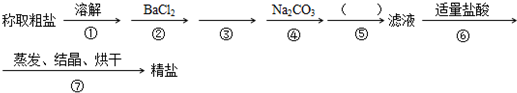
(1)判断BaCl2已过量的方法是
(2)第④步中,写出相应的化学方程式(设粗盐溶液中Ca2+的主要存在形式为CaCl2)
(3)在 中 填写所使用除杂试剂的化学式
中 填写所使用除杂试剂的化学式
(4)从实验设计方案优化的角度分析步骤②和④可否颠倒
(5)若先用盐酸再进行操作⑤,将对实验结果产生影响,其原因是:
查看习题详情和答案>>

(1)判断BaCl2已过量的方法是
取第②步后的上层清液1~2滴于点滴板上(或取少量上层清液于试管中),再滴入1~2滴BaCl2溶液,若溶液未变浑浊,则表明BaCl2已过量(合理答案皆可)
取第②步后的上层清液1~2滴于点滴板上(或取少量上层清液于试管中),再滴入1~2滴BaCl2溶液,若溶液未变浑浊,则表明BaCl2已过量(合理答案皆可)
.(2)第④步中,写出相应的化学方程式(设粗盐溶液中Ca2+的主要存在形式为CaCl2)
CaCl2+Na2CO3=CaCO3↓+2NaCl、BaCl2+Na2CO3=BaCO3↓+2NaCl
CaCl2+Na2CO3=CaCO3↓+2NaCl、BaCl2+Na2CO3=BaCO3↓+2NaCl
.(3)在
 中 填写所使用除杂试剂的化学式
中 填写所使用除杂试剂的化学式NaOH
NaOH
,在 ( )中的操作名称是过滤
过滤
.(4)从实验设计方案优化的角度分析步骤②和④可否颠倒
否
否
(填“是”或“否”,如果“否”,请说明理由.)原因是:过量的BaCl2必须要用Na2CO3除去,步骤复杂
过量的BaCl2必须要用Na2CO3除去,步骤复杂
;步骤③和④可否颠倒是
是
.(5)若先用盐酸再进行操作⑤,将对实验结果产生影响,其原因是:
会有部分沉淀溶解,从而影响制得精盐的纯度
会有部分沉淀溶解,从而影响制得精盐的纯度
.