摘要: 已知在1L MgCl2溶液中含有0.02molCl-.此溶液中MgCl2的物质的量浓度为
网址:http://m.1010jiajiao.com/timu3_id_168557[举报]
 (2013?珠海模拟)甲醇是一种优质燃料,可制作燃料电池.
(2013?珠海模拟)甲醇是一种优质燃料,可制作燃料电池.(1)为探究用 CO2 来生产燃料甲醇的反应原理,现进行如下实验:在体积为 1L 的密闭容器中,充入 1molCO2 和 3molH2,一定条件下发生反应:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol
测得 CO2 和 CH3OH(g)的浓度随时间变化如图.请回答:
①从反应开始到平衡,氢气的反应速率:v(H2)=
0.225mol/(L?min)
0.225mol/(L?min)
.②能够说明该反应已达到平衡的是
AC
AC
.A.恒温、恒容时,容器内的压强不再变化
B.恒温、恒容时,容器内混合气体的密度不再变化
C.一定条件下,CO、H2和CH3OH的浓度保持不变
D.一定条件下,单位时间内消耗3molH2的同时生成1mol CH3OH
③下列措施中能使平衡混合物中 n(CH3OH)/n(CO2) 增大的是
CD
CD
.A.加入催化剂
B.充入 He(g),使体系压强增大
C.将 H2O(g)从体系中分离
D.降低温度
④求此温度(t1)下该反应的平衡常数 K1=
5.33
5.33
(计算结果保留三位有效数字).⑤另在温度(t2)条件下测得平衡常数 K2,已知t2>t1,则K2
<
<
K1(填“>”、“=”或“<”).(2)以 CH3OH 为燃料(以 KOH 溶液作电解质溶液)可制成 CH3OH 燃料电池,则充入 CH3OH 的电极为
负
负
极,充入O2电极的反应式为3O2+12e-+6H2O═12OH-(O2+4e-+2H2O═4OH-也算对)
3O2+12e-+6H2O═12OH-(O2+4e-+2H2O═4OH-也算对)
.(3)已知在常温常压下:
①2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△H 1
②2CO(g)+O2(g)═2CO2(g)△H2
则 1mol 甲醇不完全燃烧生成一氧化碳和气态水时反应的△H=
| 1 |
| 2 |
| 1 |
| 2 |
(2011?嘉兴模拟)氟化钠的用途非常广泛,可作杀菌剂、杀虫剂和木材防腐剂.实验室可通过下图所示的流程来制取:

请结合每小题的相关信息,回答下列有关问题:
(1)已知:饱和氟硅酸(H2SiF6)溶液为无色透明的发烟液体,密度为1.32g?mLˉ1,易挥发,有刺激性气味,与等物质的量浓度的H2SO4酸性相当,它对玻璃、陶瓷都有较强的腐蚀性.以上实验所用仪器全部用聚酯类材料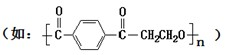 做成,在该类材料做成的容器中混合NH4HCO3固体、H2SiF6浓溶液和H2O时,加入试剂的顺序应是
做成,在该类材料做成的容器中混合NH4HCO3固体、H2SiF6浓溶液和H2O时,加入试剂的顺序应是
A.玻璃 B.铁 C.聚乳酸 D.陶瓷
(2)已知在20℃时Na2SiF6的溶解度为2.12g,请写出1L 1mol?Lˉ1的H2SiF6溶液与1L 1mol?Lˉ1Na2CO3溶液混合后(假设混合液中水的质量约等于2000g)发生化学反应的离子方程式为
(3)上述流程图中产生浑浊液的原因是生成了
A.NH4F B.H2SiO3 C.(NH4)2SiF6 D.(NH4)2CO3
(4)操作1后是否需要对沉淀进行洗涤
(5)溶液B中经操作
查看习题详情和答案>>

请结合每小题的相关信息,回答下列有关问题:
(1)已知:饱和氟硅酸(H2SiF6)溶液为无色透明的发烟液体,密度为1.32g?mLˉ1,易挥发,有刺激性气味,与等物质的量浓度的H2SO4酸性相当,它对玻璃、陶瓷都有较强的腐蚀性.以上实验所用仪器全部用聚酯类材料
 做成,在该类材料做成的容器中混合NH4HCO3固体、H2SiF6浓溶液和H2O时,加入试剂的顺序应是
做成,在该类材料做成的容器中混合NH4HCO3固体、H2SiF6浓溶液和H2O时,加入试剂的顺序应是NH4HCO3固体、H2O和H2SiF6浓溶液
NH4HCO3固体、H2O和H2SiF6浓溶液
,加好试剂后,为了让它们充分反应,不能用C
C
棒搅拌(填字母).A.玻璃 B.铁 C.聚乳酸 D.陶瓷
(2)已知在20℃时Na2SiF6的溶解度为2.12g,请写出1L 1mol?Lˉ1的H2SiF6溶液与1L 1mol?Lˉ1Na2CO3溶液混合后(假设混合液中水的质量约等于2000g)发生化学反应的离子方程式为
2H++SiF62-+2Na++CO32-=Na2SiF6↓+CO2↑+H2O
2H++SiF62-+2Na++CO32-=Na2SiF6↓+CO2↑+H2O
.(3)上述流程图中产生浑浊液的原因是生成了
B
B
(填字母).A.NH4F B.H2SiO3 C.(NH4)2SiF6 D.(NH4)2CO3
(4)操作1后是否需要对沉淀进行洗涤
是
是
(填“是”或“否”),选择“是”或“否”的原因是使沉淀表面吸附的NH4F全部转移到溶液A中,提高产品产率
使沉淀表面吸附的NH4F全部转移到溶液A中,提高产品产率
.(5)溶液B中经操作
蒸发浓缩、冷却结晶、过滤
蒸发浓缩、冷却结晶、过滤
可得到副产品氯化铵;粗产品晶体经重结晶
重结晶
(填操作名称)可得纯净的产品.请按要求回答下列问题:
(1)将100mL0.3mol?L-1的NaHSO4(设该条件下NaHSO4完全电离)溶液和100mL0.2mol?L-1的Ba(OH)2溶液充分混合,写出所发生反应的离子方程:
(2)某温度时,水的离子积常数KW═10-13,将此温度下pH═11的Ba(OH)2溶液aL与pH═1的H2SO4溶液bL混合.设混合溶液体积为两者之和,所得固体体积忽略不计.若所得混合溶液为中性,则a:b═
(3)已知在25℃的水溶液中,AgX、AgY、AgZ均难溶于水,且Ksp(AgX)═1.8×10-10,Ksp(AgY)═1.0×10-12,Ksp(AgZ)═8.7×10-17.则AgX、AgY、AgZ三者的溶解度(已被溶解的溶质的物质的量/1L溶液表示)S(AgX)、S(AgY)、S(AgZ)的大小顺序为:
查看习题详情和答案>>
(1)将100mL0.3mol?L-1的NaHSO4(设该条件下NaHSO4完全电离)溶液和100mL0.2mol?L-1的Ba(OH)2溶液充分混合,写出所发生反应的离子方程:
3H++2SO42-+2Ba2++3OH-═2BaSO4↓+3H2O
3H++2SO42-+2Ba2++3OH-═2BaSO4↓+3H2O
;若向反应后的溶液中滴加2~3滴酚酞试液,则溶液的颜色变为红色
红色
.(2)某温度时,水的离子积常数KW═10-13,将此温度下pH═11的Ba(OH)2溶液aL与pH═1的H2SO4溶液bL混合.设混合溶液体积为两者之和,所得固体体积忽略不计.若所得混合溶液为中性,则a:b═
10:1
10:1
.(3)已知在25℃的水溶液中,AgX、AgY、AgZ均难溶于水,且Ksp(AgX)═1.8×10-10,Ksp(AgY)═1.0×10-12,Ksp(AgZ)═8.7×10-17.则AgX、AgY、AgZ三者的溶解度(已被溶解的溶质的物质的量/1L溶液表示)S(AgX)、S(AgY)、S(AgZ)的大小顺序为:
S(AgX)>S(AgY)>S(AgZ)
S(AgX)>S(AgY)>S(AgZ)
;若向AgY的饱和溶液中加入少量的AgX固体,则c(Y-)减小
减小
(填“增大”、“减小”或“不变”).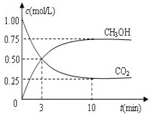 2009年10月15日新华社报道:全国农村应当在“绿色生态-美丽多彩-低碳节能-循环发展”的理念引导下,更快更好地发展“中国绿色村庄”,参与“亚太国际低碳农庄”建设.可见“低碳循环”已经引起了国民的重视,试回答下列问题:
2009年10月15日新华社报道:全国农村应当在“绿色生态-美丽多彩-低碳节能-循环发展”的理念引导下,更快更好地发展“中国绿色村庄”,参与“亚太国际低碳农庄”建设.可见“低碳循环”已经引起了国民的重视,试回答下列问题:(1)煤的汽化和液化可以提高燃料的利用率.
已知25℃,101kPa时:C(s)+1/2O2(g)=CO(g)△H=-126.4kJ?mol-1
2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ?mol-1
H2O(g)=H2O(l)△H=-44kJ?mol-1
则在25℃,101kPa时:C(s)+H2O(g)=CO(g)+H2(g)△H=
115.4 kJ?mol-1
115.4 kJ?mol-1
.(2)高炉炼铁是CO气体的重要用途之一,其基本反应为:
FeO(s)+CO(g) Fe(s)+CO2(g)△H>0,已知在1100℃时,该反应的化学平衡常数K=0.263.
①温度升高,化学平衡移动后达到新的平衡,此时平衡常数K值
增大
增大
(填“增大”、“减小”或“不变”);②1100℃时测得高炉中,c(CO2)=0.025mol?L-1,c(CO)=0.1mol?L-1,则在这种情况下,该反应是否处于化学平衡状态
否
否
(填“是”或“否”),其判断依据是因为Qc=c(CO2)/c(CO)=0.25<K=0.263
因为Qc=c(CO2)/c(CO)=0.25<K=0.263
.(3)目前工业上可用CO2来生产燃料甲醇,有关反应为:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ?mol-1.现向体积为1L的密闭容器中,充入1mol CO2和3mol H2,反应过程中测得CO2和CH3OH(g)的浓度随时间的变化如图所示.
①从反应开始到平衡,氢气的平均反应速率v(H2)=
0.225 mol/(L?min)
0.225 mol/(L?min)
;②下列措施能使
| c(CH3OH) | c(CO2) |
BD
BD
(填符号).A.升高温度 B.再充入H2 C.再充入CO2
D.将H2O(g)从体系中分离 E.充入He(g),使体系压强增大.